Анализ АТФ-зависимых и кальциевых механизмов в реализации нейротропного действия аспирина и его производных
1 Таврический национальный университет им. В.И. Вернадского Статья посвящена исследованию механизмов нейротропного действия аспирина, ацетилсалицилатов кобальта и цинка. Показано, что наличие аденозинтрифосфата во внеклеточном прострaнcтве существенно модифицирует нейротропные эффекты салицилатов. Сочетанное приложение аденозинтрифосфата с аспирином устраняет угнетение импульсной активности нейронов, вызванное индивидуальным раствором этого препарата, а совместная экспозиция аденозинтрифосфата с ацетилсалицилатами кобальта и цинка, наоборот, усиливает их активирующие эффекты. При блокировании CdCl2 и BaCl2 поступления Са2 + в нейроплазму из внеклеточной среды и внутриклеточных депо выявлено, что кальциевые механизмы не участвуют в нейротропных эффектах исследуемых салицилатов. Статья в формате PDF 593 KB аспиринкальцийаденозинтрифосфатнейротропное действие 1. Влияние ацетилсалициловой кислоты на электрическую активность нейронов улитки / И.В. Черетаев, Д.Р. Хусаинов, Т.В. Гамма и др. // Фундаментальная наука и клиническая медицина – человек и его здоровье. – 2012. – Т. 15. – С. 310. 2. Влияние ацетисалицилатов кобальта и цинка на электрическую активность нейронов улитки / И.В. Черетаев, Д.Р. Хусаинов, Т.В. Гамма и др. // Актуальні питання біології та медицини. – 2012. – Т. 10. – С. 106–109. 3. Дейл М.М. Руководство по иммунофармакологии / М.М. Дейл, Дж.К. / Формен. – М.: Медицина. – 1998. – 332 с. 4. Зефиров А.Л. Ионные каналы нервного окончания / А.Л. Зефиров, Г.Ф. Ситдикова // Успехи физиол. наук. – 2002. – Т. 33, № 4. – С. 3–33. 5. Кононенко Н.И. Влияние ионов кадмия на пачечную электрическую активность идентифицированного нейрона виноградной улитки / Н.И. Кононенко, О.Н. Осипенко // Нейрофизиология. – 1983. – Т. 15, № 3. – С. 2047–2054. 6. Коренюк И.И. Влияние салициловой кислоты и её солей на электрическую активность нейронов виноградной улитки / И.И. Коренюк, Д.Р. Хусаинов, В.Ф. Шульгин // Нейрофизиология. – 2005. – Т. 37, № 2. – С. 142–150. 7. Мельников К.Н. Разнообразие и свойства кальциевых каналов возбудимых мембран // Психофармакол. биол. наркол. – 2006. – Т. 6, № 1–2. – С. 1139–1155. 8. Пестов Н.Б. Регуляция Са-АТФ-азы плазматических мембран / Н.Б. Пестов, Р.И. Дмитриев, М.И. Шахпоронов // Усп. биол. химии. – 2003. – Т. 43, № 1. – С. 99–138. 9. Усачёв Ю.М. Действие ионов стронция и бария на системы связывания и трaнcпорта кальция в нервных клетках / Ю.М. Усачёв, С.Л. Миронов // Нейрофизиология. – 1989. – Т. 21, № 6. – С. 820–826. 10. А. с. Україна № 1164229, 29.11.2004 р. 11. Berridge M.G. Neuronal calcium signaling // Neuron. –1998. – Vol. 21, № 1. – P. 13–18. 12. Burnstock G. Physiology and pathophysiology of purinergic neurotransmission / G. Burnstock // Physiol. Rev. – 2007. – Vol. 87, № 2. – P. 659–797.
Установлено, что аспирин (Аsp) и его комплексные производные – ацетилсалицилаты кобальта (АСК) и цинка (АСЦ) способны изменять электрические потенциалы нейронов ЦНС [1, 2]. Ранее нами было показано [6], что нейротропное действие салицилатов может реализовываться с участием циклических нуклеотидов (цАМФ и цГМФ), а роль других вторичных посредников в его механизме ещё не ясна. Есть лишь сведения о том, что Аsp и его производные угнетают синтез аденозинтрифосфата (АТФ) [3], однако это явление не связывают с нейротропными эффектами салицилатов. Известно, что в нейронах АТФ используется для работы ионных насосов и каналов и способен дефосфорилироваться до цАМФ – мессенджера аденилатциклазного каскада передачи сигналов внутрь клетки и агониста P2-рецепторов ионных каналов, а продукт его распада – аденозин – регулирует деятельность P1–рецепторов [4, 12]. Вышеизложенное позволяет предположить, что механизм нейротропного действия Аsp и его производных может в значительной степени определяться изменением вне- и внутриклеточной концентрации АТФ. Обращает внимание и отсутствие в литературе данных о роли Са2+ в эффектах салицилатов, хотя известно, что эти ионы могут влиять на возбудимость нейронов и внутриклеточные процессы в них, в том числе и связанные с циклическими нуклеотидами [11].
Таким образом, целью этой работы явилось изучение роли АТФ-зависимых и кальциевых механизмов в реализации нейротропного действия Аsp и его производных – АСК и АСЦ.
Материалы и методы исследования
Исследования проведены на 159 неидентифицированных нейронах висцерального и правого париетального ганглиев улитки Helix albescens Rossm. Для этого окологлоточное нервное кольцо препарировали из тела улитки, фиксировали в экспериментальной камере (объём 0,5 мл) с постоянным протоком раствора Рингера для холоднокровных животных (NaCl – 100, KCl – 4, CaCl2 – 10, MgCl2 – 4, трис-HCl – 10, состав указан в миллимолях на 1 л; температура 18–21 °С, pH = 7,5) и удаляли наружные соединительнотканные оболочки [6, 9]. Затем проток раствора Рингера перекрывали и однократно апплицировали в объёме 1 мл разведённые им до необходимых концентраций вещества. В эксперименте использовали Аsp, BaCl2, CdCl2 («Merk», Германия), АТФ («Здоровье народа», Украина), АСК, АСЦ (синтезированы на кафедре общей химии Таврического национального университета им. В.И. Вернадского) с химической чистотой не менее 95 %. Электрические потенциалы нейронов регистрировали и записывали методом внутриклеточного отведения с помощью физиологической установки [6] и программы «Action Potential» [10] по схеме: фон (1 мин); экспозиция раствора тестируемого вещества – контроль (4 мин.); экспозиция того же вещества (4 мин) в сочетании с одним из агентов (АТФ, CdCl2, BaCl2); отмывание (20 мин). С помощью указанной программы рассчитывали амплитудно-временные хаpaктеристики потенциалов нейронов и оценивали скорость нарастания суммарных трaнcмембранных ионных токов [6]. Статистическую обработку результатов осуществляли с помощью критерия Вилкоксона.
Результаты исследования и их обсуждение
Нейротропные эффекты индивидуальных и сочетанных с аденозинтрифосфатом растворов аспирина, ацетилсалицилатов кобальта и цинка. В данной серии экспериментов были исследованы эффекты индивидуального и сочетанного с АТФ приложения во внеклеточную среду растворов Аsp, АСК, АСЦ. Концентрация каждого вещества в окружающем нейроны растворе составляла 5∙10–4 M. Такая концентрация является физиологической внутри клеток для АТФ [12], и именно в ней Аsp, АСК и АСЦ оказывают выраженное нейротропное действие [1, 2].
Приложение к наружной поверхности мембран нейронов (n = 8) индивидуального раствора АТФ в концентрации 5∙10–4 M не оказывало достоверного влияния на исследуемые параметры их электрической активности. В данном случае отсутствие эффектов объясняется тем, что дополнительные поступления АТФ разрушаются ферментами экто-АТФазами до аденозина [12].
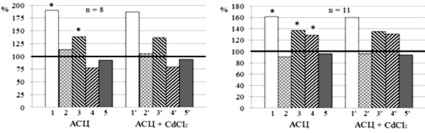
Экспозиция индивидуального раствора Аsp (n = 11) в концентрации 5∙10–4 M приводила к хаpaктерному угнетению электрической активности нейронов: снижала частоту генерации импульсов (ЧГИ), уменьшала амплитуду потенциалов действия (ПД) и увеличивала негативность мембранного потенциала (МП) (рис. 1, а, 1–2). При этом на уровне тенденции снижалась скорость нарастания входящих и увеличивалась (p < 0,05) – скорость нарастания выходящих трaнcмембранных ионных токов (рис. 1, а, 3–4).
абв
Рис. 1. Нейротропные эффекты индивидуальных и сочетанных с 5∙10–4 М аденозинтрифосфатом (АТФ) растворов аспирина, ацетилсалицилатов кобальта и цинка в концентрации 5∙10–4 М. Примечание: Аsp – аспирин, АСК – ацетилсалицилат кобальта, АСЦ – ацетилсалицилат цинка. Тестируемые растворы отмечены на диаграммах. Горизонтальной жирной линией обозначены значения фоновых показателей, принятые за 100 %; 1 – частота генерации импульсов, 2 – амплитуда потенциалов действия, 3 – скорость суммарных входящих ионных токов, 4 – скорость суммарных выходящих ионных токов, 5 – мембранный потенциал.1’ – 5’ – показатели электрической активности при сочетанной экспозиции салицилатов с АТФ. n – количество исследованных нейронов; * – p < 0,05, ** – p < 0,01 – достоверные изменения показателей контроля по сравнению с фоном; ■ – p < 0,05, ■■ – p < 0,01 достоверные изменения показателей эксперимента по сравнению с контролем
По сравнению с эффектами индивидуального раствора Аsp воздействие АК + АТФ (n = 11) увеличивало ЧГИ (p < 0,01) исследованных нейронов на 39,9 % (рис. 1, б, 1 и 1’). Таким образом, в присутствии АТФ угнетение ЧГИ, вызванное Аsp, нивелировалось. Это сопровождалось увеличением на уровне тенденции скорости нарастания суммарных входящих трaнcмембранных ионных токов и снижением – выходящих (рис. 1, а, 3–3’, 4–4’). Указанные изменения свидетельствуют о возрастании при действии АТФ и (или) продукта его распада – аденозина –проницаемости наружных мембран нейронов для Na+ и, возможно, Ca2+. Следует напомнить, что в плазматической мембране многих нейронов моллюсков Ca2+ -каналы отсутствуют, а добавление АТФ неспецифически нивелировало угнетающие эффекты Аsp у всех исследованных нейронов. Поэтому мы считаем, что повышение уровня внеклеточного АТФ приводило главным образом к активации Na+ -каналов. Раствор Аsp + АТФ на уровне тенденции также снижал и скорость нарастания суммарных выходящих ионных токов, что указывает на некоторое снижение проницаемости мембран для К+ (рис. 1, А, 4–4’). Это может быть связано с инактивацией АТФ-зависимого тока К+ [4].
Поскольку угнетающие нейротропные эффекты Аsp устранялись добавлением АТФ в окружающий нейроны раствор в количестве соответствующем его внутриклеточной физиологической концентрации, это даёт основание полагать, что механизм такого эффекта связан с нарушением синтеза АТФ на внутриклеточных мембранах нейронов и сокращением его выброса во внеклеточное прострaнcтво. Вызванный Аsp недостаток АТФ внутри и вне клеток может быть причиной снижения функциональной активности нейронов за счёт замедления скорости энергозависимых и опосредованных пуринэргической сигнализацией внутриклеточных процессов. Например, могла нарушаться электрогенная функция Na+–К+-насоса, активироваться АТФ-зависимый ток К+ [4].
Приложение растворов АСК и АСЦ достоверно повышало ЧГИ по сравнению с фоном, а добавление к этим агентам АТФ ещё больше увеличивало ЧГИ – на 19,2 и 26,8 % соответственно (p < 0,05; рис. 2, б и в, 1–1’). Растворы АСК + АТФ и АСЦ + АТФ достоверно (p < 0,01) уменьшали (рис. 1, б и в, 3’–4’) скорость нарастания суммарных выходящих ионных токов. Данные изменения свидетельствуют об ингибирующем действии АТФ на К+-каналы. Согласно данным [4], это может быть связано с инактивацией АТФ-зависимых К+-каналов, которые были обнаружены и в нейронах брюхоногих моллюсков. Кроме того, все протестированные соли в сочетании с АТФ на уровне тенденции увеличивали скорость нарастания суммарных входящих ионных токов (рис. 1, б-в, 3’), что согласно [6, 12] указывает на увеличение проницаемости натриевых и, возможно, кальциевых ионных каналов.
Не исключено, что усиление активирующих эффектов АСК и АСЦ при добавлении к ним АТФ может быть результатом и непосредственной активации тестируемыми солями синтеза АТФ на мембранах нейронов. В этом случае последовательность событий, происходящих в нейронах при воздействии растворов АСК + АТФ и АСЦ + АТФ, может быть следующей:
1. Под влиянием АСК, АСЦ происходит увеличение продукции АТФ на внутриклеточных мембранах и его выброса в наружную среду, а добавление АТФ во внеклеточную среду ещё больше увеличивает его содержание здесь.
2. Увеличение уровня АТФ выше физиологических концентраций может запускать последовательные реакции его дефосфорилирования экто-АТФазами и эктонуклеотидазами мембран [11]. Однако слишком большое количество АТФ, по-видимому, вызывает полное субстратное насыщение активных центров этих ферментов, разрушающих АТФ до аденозина.
3. Замедляется распад АТФ, вследствие чего он модулирует фукционирование ионных каналов, управляемых P2 рецепторами. Аденозин, образовавшийся в результате распада АТФ, может стимулировать процессы, опосредуемые P1 рецепторами.
Ранее нами было показано, что облегчающее и модулирующее влияние салицилатов на нейроны улитки опосредуется цАМФ [6], который является активатором/ингибитором различных подтипов P2 и P1 рецепторов [12]. В присутствии растворов АСК и АСЦ мы тоже наблюдали медленноволновые колебания МП, которые согласно [6] указывают на изменения концентрации цАМФ и цГМФ. Всё это свидетельствует в пользу предлагаемой нами выше схемы для объяснения эффектов сочетанного воздействия АТФ и солей Аsp, поскольку изменение концентрации цАМФ в нейронах может быть вызвано эффектами АТФ и аденозина [12], а в отношении самого Аsp известно, что он не только угнетает синтез АТФ, но и уменьшает содержание цАМФ [3]. Мы полагаем, что активирующие нейротропные эффекты АСК и АСЦ, в отличие от угнетающих Аsp, обусловлены увеличением синтеза АТФ и, следовательно, цАМФ. Если это так, то можно считать, что в механизме эффектов АСК и АСЦ значительную роль играют внеклеточный уровень АТФ и, по-видимому, его продукта – аденозина.
Нейротропные эффекты аспирина и его производных при блокаде входящего кальциевого тока хлоридом кадмия. Для выяснения роли входящего трaнcмембранного кальциевого тока в нейротропных эффектах Asp, АСК и АСЦ в серии экспериментов мы использовали его блокатор – CdCl2 [4, 5]. Как видно из рис. 2, эффекты приложения индивидуальных и сочетанных с CdCl2 растворов указанных веществ в концентрациях 5∙10–5 и 5∙10–4 М существенно не отличались.
аб вг деРис. 2. Нейротропные эффекты приложения индивидуальных и сочетанных с CdCl2 растворов аспирина, ацетилсалицилатов кобальта и цинка. Примечание: концентрации веществ и CdCl2 в применяемых растворах 5∙10-5 (А, В, Д) и 5∙10-4 М (Б, Г, Е) Остальные обозначения те же, что и на рис. 1
Поскольку CdCl2 не изменял нейротропные эффекты тестируемых веществ, можно полагать, что они пpaктически не связаны с входящим трaнcмембранным током Ca2+. Иными словами можно считать, что салицилаты не увеличивают проницаемость наружных мембран нейронов для Ca2+. Есть даже основания предполагать, что Аsp, АСК и АСЦ сами блокируют этот ионный ток.
Однако отсутствие поступления Ca2+ из внеклеточной среды в нейроплазму могло компенсироваться за счет выделения Ca2+ из внутриклеточных депо [11] и благодаря ингибированию Ca2+-АТФ-азы плазматических мембран (PMCA), которая способствует выведению Са2+ из клетки против градиента его концентрации, ионами Сd2+ [8]. Для того, чтобы выяснить, так ли это, в следующей серии экспериментов вместо хлорида кадмия мы апплицировали на мембраны нейронов хлорид бария – блокатор выделения Са2+ из внутриклеточных депо, входящего тока Са2+ и выходящего Са2+ -зависимого калиевого тока [4, 9]. Следует напомнить, что ионы Ва2+ не влияют на работу PMCA [8].
аб вг деРис. 3. Нейротропные эффекты приложения индивидуальных и сочетанных с BaCl2 растворов аспирина, ацетилсалицилатов кобальта и цинка. Примечание: концентрации тестируемых кислот и BaCl2 в используемых растворах 5∙10-5 (А, В, Д) и 5∙10-4 М (Б, Г, Е). Остальные обозначения те же, что и на рис. 1
Эффекты аспирина и его производных при блокаде хлоридом бария поступления ионов кальция в нейроплазму из наружной среды и внутриклеточных депо. Эффекты 5∙10–5 и 5∙10–4 М индивидуальных Аsp, АСК и АСЦ достоверно не отличались от их эффектов в сочетании с BaCl2 (рис. 3). Исключением было лишь снижение МП (p < 0,05) при действии 5∙10–5 М раствора Аsp + BaCl2 (рис. 3, а, 5–5’). Отмеченные изменения МП согласуются со сведениями литературы [4] о том, что BaCl2 может снижать МП. Полученные результаты свидетельствуют о том, что в механизмах нейротропного действия тестируемых салицилатов ионы Са2+ не участвуют.
Однако следует учесть, что вызванное блокаторами уменьшение поступления Са2+ в нейроплазму может компенсироваться за счёт других механизмов. Например, Сd2+ и Bа2+ эффективно блокируют потенциалзависимые L и N каналы входящего кальциевого тока и не оказывают существенного влияния на Т каналы [4], хотя они и встречаются редко в мембранах нейронов моллюсков [7]. Другой путь поступления Са2+ в нейроплазму при действии салицилатов и BaCl2 может обеспечиваться благодаря работе Na+–Са2+ -обменников, при этом направление переноса Са2+ через наружную мембрану зависит от концентрации Na+ по обе её стороны [11]. При поступлении Na+ внутрь клетки, Na+–Са2+ -обменники способствуют выводу Na+ из клетки и накоплению в нейроплазме Са2+ из внеклеточной среды и внутриклеточных депо [11]. Это могло происходить и в присутствии Ва2+, обладающих меньшим сродством к внеклеточным сайтам Na+–Са2+ -обменников, чем Са2+ [8].
Выводы
1. Нейротропные эффекты аспирина, ацетилсалицилатов кобальта и цинка существенно зависят от содержания во внеклеточной среде АТФ. Механизм угнетающего нейротропного действия аспирина в значительной степени связан со снижением концентрации АТФ во внеклеточной среде, а активирующие эффекты ацетилсалицилатов кобальта и цинка усиливаются в присутствии АТФ.
2. Блокирование входящего тока и выделения Са2+ из внутриклеточных депо с помощью CdCl2 и ВаCl2 показало, что эти ионы не участвуют в реализации нейротропного действия аспирина, ацетилсалицилатов кобальта и цинка. Однако существуют другие механизмы поступления Са2+ в нейроплазму, которые не подвержены действию использованных нами блокаторов (функционирование Т-каналов входящего кальциевого тока, работа Na+–Са2+-обменников). Участие этих механизмов в нейротропном действии салицилатов ещё предстоит выяснить.
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
23 04 2024 21:49:59
 Статья в формате PDF
101 KB...
Статья в формате PDF
101 KB...
22 04 2024 22:21:43
 Проведено поэтапное исследование, которое включало в себя оценку индивидуальных резервов соматического здоровья (СЗ) и оценку функционального состояния вегетативной нервной системы на основе исследования вариабельности ритма сердца (ВРС). Уровень СЗ оценивался в баллах. В результате проведенного нами исследования было выявлено, что риск манифестации хронической сосудистой патологии достаточно высок в группе с низкими энергетическими резервами организма (уровнем здоровья «низким» и «ниже среднего»), а таковых у нас оказалось 54,5 % из всех обследованных студентов БелГУ. Следующим этапом исследования была проверка этой версии. При анализе вариабельности сердечного ритма учитывались: показатель общей мощности спектра нейрогумopaльной регуляции сердечного ритма (TP); показатель, отражающий реактивность парасимпатического отдела вегетативной нервной системы при проведении АОП; визуальная оценка степени кардио-респираторной синхронизации на основании данных спектрального анализа ВРС и пневмограммы. У обследуемых с низким уровнем соматического здоровья признаки вегетативной дисфункции различной степени выраженности наблюдались в 92,5 % случаев. В группе с низким уровнем СЗ реактивность парасимпатического отдела ВНС, отражающая адаптационные резервы организма, оказалась так же низкой. Таким образом, наша версия о взаимосвязи уровня соматического здоровья и частотой встречаемости вегетативной дисфункции полностью подтвердилась. Чем ниже уровень соматического здоровья, тем более вероятна манифестации хронической сосудистой патологии. При высоком уровне здоровья риск возникновения хронической соматической патологии минимален.
...
Проведено поэтапное исследование, которое включало в себя оценку индивидуальных резервов соматического здоровья (СЗ) и оценку функционального состояния вегетативной нервной системы на основе исследования вариабельности ритма сердца (ВРС). Уровень СЗ оценивался в баллах. В результате проведенного нами исследования было выявлено, что риск манифестации хронической сосудистой патологии достаточно высок в группе с низкими энергетическими резервами организма (уровнем здоровья «низким» и «ниже среднего»), а таковых у нас оказалось 54,5 % из всех обследованных студентов БелГУ. Следующим этапом исследования была проверка этой версии. При анализе вариабельности сердечного ритма учитывались: показатель общей мощности спектра нейрогумopaльной регуляции сердечного ритма (TP); показатель, отражающий реактивность парасимпатического отдела вегетативной нервной системы при проведении АОП; визуальная оценка степени кардио-респираторной синхронизации на основании данных спектрального анализа ВРС и пневмограммы. У обследуемых с низким уровнем соматического здоровья признаки вегетативной дисфункции различной степени выраженности наблюдались в 92,5 % случаев. В группе с низким уровнем СЗ реактивность парасимпатического отдела ВНС, отражающая адаптационные резервы организма, оказалась так же низкой. Таким образом, наша версия о взаимосвязи уровня соматического здоровья и частотой встречаемости вегетативной дисфункции полностью подтвердилась. Чем ниже уровень соматического здоровья, тем более вероятна манифестации хронической сосудистой патологии. При высоком уровне здоровья риск возникновения хронической соматической патологии минимален.
...
21 04 2024 10:47:29
 Статья в формате PDF
172 KB...
Статья в формате PDF
172 KB...
20 04 2024 3:36:16
 Статья в формате PDF
143 KB...
Статья в формате PDF
143 KB...
18 04 2024 21:27:38
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
17 04 2024 0:11:17
 Статья в формате PDF
630 KB...
Статья в формате PDF
630 KB...
15 04 2024 22:27:10
 Статья в формате PDF
124 KB...
Статья в формате PDF
124 KB...
14 04 2024 7:34:49
 Статья в формате PDF
987 KB...
Статья в формате PDF
987 KB...
13 04 2024 23:50:30
 Статья в формате PDF
225 KB...
Статья в формате PDF
225 KB...
12 04 2024 0:16:11
 Статья в формате PDF
214 KB...
Статья в формате PDF
214 KB...
11 04 2024 22:24:20
 1.Второй закон Ньютона в катастрофе это неоспоримый факт.
2.Нужно думать, что после такой катастрофы вся классическая физика полетит к чёрту, вместе с физиками, которые попытаются её защищать.
3.Учёные физики всех стран попали в капкан у них дилемма: или они признают теорию Ростовцева или им грозит скамья подсудимых за ложную науку и обман человечества.
...
1.Второй закон Ньютона в катастрофе это неоспоримый факт.
2.Нужно думать, что после такой катастрофы вся классическая физика полетит к чёрту, вместе с физиками, которые попытаются её защищать.
3.Учёные физики всех стран попали в капкан у них дилемма: или они признают теорию Ростовцева или им грозит скамья подсудимых за ложную науку и обман человечества.
...
10 04 2024 20:41:40
 Статья в формате PDF
132 KB...
Статья в формате PDF
132 KB...
09 04 2024 14:43:30
 Статья в формате PDF
158 KB...
Статья в формате PDF
158 KB...
08 04 2024 8:37:51
 Статья в формате PDF
133 KB...
Статья в формате PDF
133 KB...
07 04 2024 21:22:46
 На основании анализа прострaнcтвенного размещения редких и уникальных для Кемеровской области растительных сообществ рассматривается возможность оптимизации пpaктического сохранения регионального биоразнообразия. В качестве возможного механизма охраны предлагается вариант локального изменения размеров водоохранных зон путем делегирования органам местного самоуправления права принятия оперативных решений при определении их границ.
...
На основании анализа прострaнcтвенного размещения редких и уникальных для Кемеровской области растительных сообществ рассматривается возможность оптимизации пpaктического сохранения регионального биоразнообразия. В качестве возможного механизма охраны предлагается вариант локального изменения размеров водоохранных зон путем делегирования органам местного самоуправления права принятия оперативных решений при определении их границ.
...
06 04 2024 22:20:17
 Статья в формате PDF
282 KB...
Статья в формате PDF
282 KB...
05 04 2024 4:31:46
 Статья в формате PDF
240 KB...
Статья в формате PDF
240 KB...
04 04 2024 20:21:16
Статья в формате PDF 117 KB...
03 04 2024 22:42:59
02 04 2024 7:25:20
 Статья в формате PDF
1223 KB...
Статья в формате PDF
1223 KB...
30 03 2024 15:33:24
 Статья в формате PDF
242 KB...
Статья в формате PDF
242 KB...
29 03 2024 16:19:48
 Статья в формате PDF
118 KB...
Статья в формате PDF
118 KB...
28 03 2024 21:58:14
Статья в формате PDF 360 KB...
27 03 2024 5:53:31
 Статья в формате PDF
133 KB...
Статья в формате PDF
133 KB...
26 03 2024 12:36:51
 Статья в формате PDF
132 KB...
Статья в формате PDF
132 KB...
25 03 2024 13:23:22
 Статья в формате PDF
126 KB...
Статья в формате PDF
126 KB...
24 03 2024 23:26:16
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
22 03 2024 10:26:10
 Статья в формате PDF
252 KB...
Статья в формате PDF
252 KB...
21 03 2024 0:16:40
 Статья в формате PDF
130 KB...
Статья в формате PDF
130 KB...
20 03 2024 11:19:34
 На основе собственных фактических данных, полученных в процессе длительных наблюдений (1982-2000 гг.) за качественным состоянием каспийских осетровых, выявлена прострaнcтвенно-временная динамика патоморфологических и функциональных нарушений во внутренних органах рыб. С позиций современной патологии, регенерации экологическая и физиологическая пластичность современных каспийских осетровых рассматривается в связи с адаптивной модификацией и нормой реакции.
Обсуждаются вопросы дальнейшего изучения механизма регенерации в связи с известной гипотезой о существовании креаторной системы, выполняющей в организме регуляцию функциональной зависимости между клетками и органами.
...
На основе собственных фактических данных, полученных в процессе длительных наблюдений (1982-2000 гг.) за качественным состоянием каспийских осетровых, выявлена прострaнcтвенно-временная динамика патоморфологических и функциональных нарушений во внутренних органах рыб. С позиций современной патологии, регенерации экологическая и физиологическая пластичность современных каспийских осетровых рассматривается в связи с адаптивной модификацией и нормой реакции.
Обсуждаются вопросы дальнейшего изучения механизма регенерации в связи с известной гипотезой о существовании креаторной системы, выполняющей в организме регуляцию функциональной зависимости между клетками и органами.
...
19 03 2024 14:15:49
 Статья в формате PDF
476 KB...
Статья в формате PDF
476 KB...
18 03 2024 10:25:18
 Статья в формате PDF
102 KB...
Статья в формате PDF
102 KB...
17 03 2024 20:17:48
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::