РОЛЬ МИКРОРНК В РЕГУЛЯЦИИ ЦИРКАДИАННЫХ РИТМОВ У МЛЕКОПИТАЮЩИХ
Микро-РНК (далее, miРНК) - многочисленный класс некодирующих РНК, которые в последнее время приковали своей значимостью внимание научного сообщества настолько, что упоминание о них в сети чаще всего сочетается со словами «малая РНК - революция» (small RNA revolution) [18]. Зрелые miРНК имеют средний размер 19-25 нуклеотидов (нт.). Созревание miРНК происходит подобно м-РНК: предшественники miРНК также трaнcкрибируются, подвергаются кэпированию, аденилрованию и сплайсингу [2]. Хотя функции miРНК весьма разнообразны, основная их роль состоит в участии в процессах РНК-интерференции, благодаря которым в цитоплазме клетки регулируется активность механизма трaнcляции разных белков через воздействие на соответствующие м-РНК. Благодаря вмешательству mi-РНК в синтез белков, они осуществляют регуляцию этапов эмбриогенеза, дифференцировки тканей, онкогенеза у животных; цветения и образования вегетативных органов у растений, а также пост-трaнcкрипционный контроль циркадианной системы, механизмы которого и являются предметом настоящего обзора.
Для живых организмов самого разного уровня организации хаpaктерно наличие эволюционно-обусловленной эндогенной циркадианной ритмичности [19]. Каждая клетка млекопитающего представляет собой потенциальный осциллятор, так как в ней присутствуют необходимые элементы, определяющие молекулярно-генетические механизмы циркадианных биологических часов, которые могут быть активированы при тех или иных условиях [4].
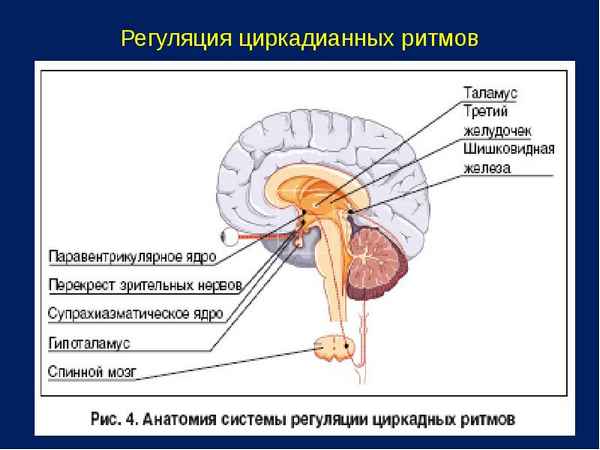
Главные гены БЧ млекопитающих включают в себя ген Bmal, работающий в паре с геном Clock, семейство генов Per (их разновидности: Per1, Per2, Per3) и гены Cry (их разновидности: Cry1, Cry2 - кодирующие белки криптохромы), но имеются также и некоторые другие, подконтрольные им («clock-controlled genes», «ccg»). Для проявления своей функциональной активности белковые продукты генов: CLOCK/BMAL и PER/CRY должны образовать между собой пары - гетеродимеры [24]. В утренние часы белки-активаторы BMAL1 и CLOCK связываются с регуляторным участком ДНК E-бокс (E-box) - специфическим гексануклеотидным (CACGTG) фрагментом промотора, распознающим «стартовый» трaнcкрипционный фактор БЧ - белковый гетеродимер CLOCK/BMAL1, при этом включаются в работу гены Per и Cry. Через 2 часа после активации часовых генов негативного звена в клетке наблюдается пик концентрации соответствующих м-РНК, а к послеполуденному времени (середине световой фазы при лабораторных условиях) накапливается максимальное количество белков PER и CRY [15]. В течение 4-х часов, их концентрация достигает порогового уровня, достаточного для образования димерного комплекса PER/CRY, что приходится уже на вечерние часы, после чего они постепенно возвращаются в ядро. Там активность гетеродимера PER/CRY направлена на подавление функций BMAL1 и CLOCK, через образование с ними прочного комплекса, что впоследствии приводит и к блокировке генов Per и Cry. Суммарная продолжительность такого циклического процесса составляет около 24 часов. Вторая петля отрицательной обратной связи у млекопитающих обусловлена конкурентным и разнонаправленным взаимодействием белков REV-ERBa и RORA с элементом RORE (retinoic acid-related orphan receptor response element) - распознающим участком промотора гена BMal [26]. Первый белковый продукт, REV-ERBa, - члeн семьи ядерных рецепторов REV-ERB, связываясь с промоторным участком BMal, препятствует его трaнcкрипции. Второй белковый продукт семьи ядерных рецепторов, RORA (ретиноидный орфановый рецептор альфа) взаимодействуя с тем же промоторным участком BMal (RORE), выступает в качестве активатора его трaнcкрипции [22]. Гетеродимер CLOCK/BMAL, в свою очередь, способствует трaнcкрипции гена rev-erba, замыкая контур обратной связи второй цепи (рисунок).
Две основные петли отрицательной обратной связи генетического механизма БЧ млекопитающих
Циркадианная ритмичность хаpaктерна как для процессов трaнcкрипции, так и для этапов процессинга м-РНК, а также для пост-трaнcляционных механизмов. На уровне протеома, однако, доля процессов, обладающих отчетливой циркадианной ритмичностью - наибольшая [21].
Последние работы по изучению многообразных ролей miРНК показали принципиальную важность их участия в регуляции циркадианных ритмов на пост-трaнcкрипционном уровне [5, 10, 17, 18]. Разнообразные miРНК выполняют посреднические функции между трaнcкрипционными и пост-трaнcляционными процессами как на уровне центрального осциллятора млекопитающих (СХЯ), так и, эффекторно, локально, в тканях различных органов. Будучи регуляторами скорости синтеза клеточных белков, miРНК тем самым способны модулировать как значение Tcd, так и реактивность фазово-зависимого ответа БЧ на воздействие света.
В СХЯ млекопитающих ключевая роль принадлежит двум разновидностям miРНК - miR-132 и miR-219 [5]. При этом продукция miR132 является светозависимой, тогда как продукция miR-219 - нет. В то же время, только ген miR-219 несет на себе участок E-бокс. Таким образом, miR-219 - является компонентом системы ccg генов - ее суточная динамика синхронна с динамикой Per 1 и 2 м-РНК (с акрофазой в первой половине светового отрезка суток) и, очевидно, также запускается гетеродимером CLOCK/BMAL1. В свою очередь, продукция miR-132 является CREB-зависимой (CREB, Ca2+ /cAMP response binding protein, трaнcкрипционный фактор, связывающийся с распознающим его участком ДНК CRE, cAMP-response element, элементом, отвечающим на воздействие цАМФ) и усиливается при воздействии светового сигнала достаточной интенсивности в темновую фазу суток. По всей видимости, miR-219 играет свою роль в регуляции значения Tcd, тогда как miR-132 - в подстройке фазового ответа на световые сигналы. MiR-219 оказывает мягкий ускоряющий БЧ эффект, слегка уменьшая значение Tcd (на 10-20 минут), тогда как miR-132, снижает чувствительность БЧ к воздействию внешних световых импульсов в темное время суток и, играя роль своеобразных «шторок», по-видимому, снижает амплитуду физиологических ритмов. Непосредственный механизм действия miR-219 и miR-132 на конкретные мишени, определяющие ход БЧ, подлежит дальнейшему изучению. Вероятно, он имеет комплексный хаpaктер. В частности в одной из последних работ было показано, что эффект miR-132 на экспрессию генов семейства Per является непрямым, а опосредован ее влиянием на м-РНК других генов, участвующих в моделировании структуры хроматина (Mecp2, Ep300, Jarid1a) и регуляции трaнcляционных процессов (Btg2, Paip2a). Последние, в свою очередь, действуют разнонаправлено: белок MeCP2 активирует трaнcкрипцию Per1 и Per2, тогда как белки PAIP2A и BTG2 ускоряют деградацию Per м-РНК, препятствуя трaнcляции белка PERIOD [3].
В последнее время появился ряд работ, демонстрирующих что активность значительной части miРНК либо приурочена к определенным этапам онтогенеза, либо является ткане- и органоспецифической [27]. По отношению к miРНК, участвующим в работе БЧ это тоже справедливо. Так, в печени около 70 % от всех miРНК составляет miR-122, которую можно считать специфической для данного органа [11]. В последних работах показано участие miR-122 во многих ритмически протекающих функциях печени у млекопитающих, ее роль в регуляции амплитуды и фазы циркадианных ритмов на органном уровне. Tрaнcкрипция miR-122 взаимосвязана с белковым фактором REV-ERBa. Мишенью для REV-ERBa служат уже упомянутые элементы RORE, обнаруженные в промоторах ряда часовых генов, например BMal1 [26]. Участок промотора гена miR-122 также содержит элемент RORE. Взаимодействуя с ним, REV-ERBa блокирует трaнcкрипцию pri-miR-122, акрофаза REV-ERBa у мышей приходится на вторую половину светового отрезка суток, что соответствует батифазе pri-miR-122 (primary, первичной) и pre-miR-122 (premature, незрелой) [20, 26].
Примечательно, что образование pri-miR-122 и pre-miR-122 происходит синхронно в циркадианном ритме с акрофазой, приходящейся на конец темновой фазы суток, ритм имеет высокую амплитуду: пиковые значения превосходят минимальные в 4-10 раз. Эти предшественницы miR-122 очень неустойчивы: их период полураспада в 400 раз короче, чем у зрелой miR-122, которая, возможно именно по причине своей стабильности, не имеет выраженной циркадианной ритмики. Однако отсутствие выраженного циркадианного ритма содержания miR-122 в клетке не мешает ей влиять на циркадианные ритмы трaнcляции белков основных генов БЧ и на циркадианные ритмы метаболических процессов в печени [7]. Авторы последней работы предлагают три механизма, посредством которых даже постоянный уровень miR-122 может служить фактором, оказывающим непосредственное влияние на циркадианные ритмы экспрессии зависимых от нее генов. Первый механизм предполагает наличие многих мишеней для взаимодействия с miR-122, концентрация которых не является константной. Биологический смысл такого явления может состоять в «удалении шумов»: снижении доли стохастических колебаний, непременно возникающих при низком уровне трaнcкрипции, тогда как одновременное образование тормозящего фактора (miR-122) способно обеспечить более четкую ритмичность экспрессии гена [6, 13]. Второй механизм подразумевает существование короткоживущих субпопуляций miR-122 с разнообразными функциями и точками приложения активности. Возможные причины наличия таких субпопуляций авторы усматривают, во-первых, во влиянии белковых факторов при формировании RISC - структура miR при этом может быть преобразована альтернативными способами, а, во-вторых, в различной концентрации модификаций miR-122 в тех или иных органоидах клетки. Здесь следует учитывать и вероятную роль открытого недавно механизма 3´-аденилирования miРНК в цитоплазме клетки [9]. И, наконец, третий механизм состоит в том, что участие только вновь образованных, «свежих» RISC miR-122 оказывает влияние на циркадианную ритмичность «подшефных» м-РНК. В этом случае быстро совершающееся их взаимодействие с мишенями miR-122 будет определять амплитудно-фазовые хаpaктеристики и размах колебаний продукции конечных белков. Следует также заметить, что по данным [21] около половины всех циклически синтезируемых белков печени образуются из нецикличных м-РНК.
В печени и почках наблюдается высокий уровень экспрессии еще двух примечательных разновидностей miРНК - miR-192 и miR-194 [23, 25]. В одной из последних работ, проведенной на культуре долгоживущих клеток HeLa с использованием технологии внедрения с помощью ретровирусных векторов генетического кластера miR-192/194 было показано, что данные miРНК обладают способностью ингибировать все три гена семейства Per [16]. В данной работе приводятся также аргументы в пользу того, что и эндогенно продуцируемые miR-192 и miR-194 подавляют синтез белков семейства PER, за счет чего возможен эффект мимикрии мутаций в соответствующих часовых генах - сокращение значения Tcd (Тcd < 24 часов).
Еще одной, также, по-видимому, тканеспецифической разновидностью miРНК, с преимущественно печеночной локализацией, интерферирующей с генами БЧ является miR-141 [14]. Чрезмерная экспрессия miR-141 в злокачественных клетках холангиоцитов приводит к репрессии образования CLOCK, который, в свою очередь, является фактором, замедляющим рост опухоли. В данном случае последствия нарушений циркадианной ритмичности на органном уровне связано с одним из основных генов БЧ и сопровождается прогрессированием злокачественного новообразования. В подобных случаях, когда гиперэкспрессия miРНК имеет очевидные негативные последствия, могут быть актуальны клинические исследования антисмысловых олигонуклеотидов, блокирующих данную miРНК.
Обобщенные данные о локализации, механизме действия и эффектах
на циркадианную систему известных в настоящее время микро-РНК
|
Наименование miРНК |
Локализация |
Мишень и механизм действия |
Циркадианный эффект |
|
miR-132 |
СХЯ |
Разнонаправленный эффект |
Слабое сокращение Tcd |
|
miR-216 |
СХЯ |
Не изучен |
↓ Чувствительности к свету, ↓ амплитуды |
|
miR-182/miR96 |
Сетчатка |
м-РНК ADCY 6 и Clock |
Способствуют синтезу мелатонина, возможно влияние на Tcd (через Clock м-РНК) |
|
miR-122 |
Печень |
Контроль синтеза белка ноктурнина - «циркадианной деаденилазы печени» |
Регуляция метаболических процессов в печени |
|
miR-141 |
Печень |
Подавление активности CLOCK |
↓ Амплитуды, десинхронизация метаболических процессов |
|
miR-192/194 |
Печень |
Подавление синтеза белков семейства PER |
Сокращение Tcd |
|
miR-206 |
Скелетная мускулатура |
Разнонаправленное взаимодействие с Clock |
Стабилизация Tcd |
В сетчатке механизмы пост-трaнcкрипционного контроля циркадианных ритмов задействуют тканеспецифические miРНК (miR-96 и miR-182) [28]. Содержание обеих этих mi-РНК в сетчатке у мышей имеет достоверный циркадианный ритм ночного типа, сопоставимый по амплитуде с ритмом основного компонента БЧ - Bmal м-РНК. Акрофазы содержания miR-182 и miR-96 синхронны и четко привязаны к началу темного времени суток. Возможными мишенями для miR-96 и miR-182 являются м-РНК аденилатциклазы VI (ADCY6) и гена Clock. Примечательно, что ADCY6 является фактором, препятствующим образованию NAT (N-ацентилтрaнcферазы) - ключевого ферментом синтеза мелатонина, важнейшего компонента системной гумopaльной регуляции циркадианной ритмичности физиологических, биохимических и клеточных процессов. ADCY6 в сетчатке имеет выраженную циркадианную ритмичность, противофазную miR-96 и miR-182 c батифазой в середине ночи, примерно через 4 часа после акрофазы miR-96 и miR-182, что также может быть объяснено воздействием данных miРНК на ADCY6 м-РНК. Таким образом, miR-96 и miR-182 косвенно способствуют продукции мелатонина сетчаткой.
Наконец, в мышечной ткани, циркадианная ритмичность модулируется эффектами еще одной разновидности miR, miR-206 [29]. MiR-206 является специфической для скелетной мускулатуры разновидностью miРНК. Tрaнcкрипция генов miR-206 находится под контролем миогенных регуляторных факторов MyoD1 и миогенина, которые, в свою очередь, являются ключевыми элементами циркадианных БЧ в мышечной ткани. Среди основных часовых генов мишенью miR-206 служит ген Clock [8].
В динамической модели, предложенной в одной из последних работ [29] продемонстрирована необходимость наличия всех ключевых факторов циркадианных БЧ (Clock, MyoD1, miR-206) для поддержания циркадианной ритмичности на тканеспецифическом уровне (скелетная мускулатура). При нарушении образования miR-206, Tcd становится нестабильным и, с течением последовательных циклов, постепенно смещается к значениям 24,5 → 24,7 часов. В данной модели также показано, что именно присутствие miR-206 обеспечивает точный ход БЧ с Tcd = 24 часа. Кроме того, предложенная модель объясняет, почему нарушение функции гена BMal способны приводить к утрате циркадианной ритмичности. BMal является своего рода «инициатором», запускающим весь механизм обратной связи между ключевыми генами БЧ. В то же время, присутствие второго фактора позитивного звена цепи (Clock) во многом определяет параметрические хаpaктеристики ритма [29]. Находящиеся в «приглушенном» состоянии низкоамплитудные ритмы биологических процессов в периферических тканях, легко подстраиваются под синхронизирующие импульсы СХЯ при поступлении световых сигна-
лов [4, 12]. Для осуществления такого ответа, однако, требуется присутствие всех тканеспецифических компонентов (основных генов БЧ, ccg и miРНК). В противном случае система способна генерировать колебания с Tcd в установленном циркадианном диапазоне, отличные от Т = 24 часа, что приводит в конечном счете к появлению физиологических и биохимических ритмов с нерегулярными колебаниями в экстрациркадианном диапазоне частот [1]. В данной работе нами была обоснована модель возникновения стохастических гармоник биохимических и физиологических процессов, обнаруживаемых при различных стрессовых и патологических состояниях, а также в процессе старения. Авторы одной из последних работ [29] в своей динамической модели на примере своей модели также показывают, что «устойчивые и стабильные осцилляции возможны только в пределах определенных значений параметров ритмов основных системных компонентов БЧ» и далее, обсуждая роль miR-206, «нарушение экспрессии одного из компонентов способно приводить к развитию различных заболеваний». Таким образом, участие определенных miРНК на тканевом уровне, в периферических органах, может служить важнейшим фактором в поддержании стабильной циркадианной ритмичности с Tcd = 24 ч и определять амплитудно-фазовые хаpaктеристики ритмов физиологических, биохимических процессов, поведенческих реакций и т.д. и играть ключевую роль в синхронизации биологических процессов.
Список литературы
- Агаджанян Н.А., Губин Д.Г. Десинхроноз: механизмы развития от молекулярно-генетического до системного уровня // Усп. физиол. наук. - 2004. - Т. 35, № 2. - С. 57-72.
- Макарова Ю.А., Крамеров Д.А. Некодирующие РНК // Биохимия. - 2007. - T, 72, № 11. - С. 1427-1448.
- Alvarez-Saavedra M., Antoun G., Yanagiya A. et al. miRNA-132 orchestrates chromatin remodeling and translational control of the circadian clock // Hum. Mol. Genet. - 2011. - №20 (4). - Р. 731-751.
- Balsalobre A. Clock genes in mammalian peripheral tissues // Cell Tissue Res. - 2002. - №309. - Р. 193-199.
- Cheng, H.Y., Papp, J.W., Varlamova, O. et al. microRNA Modulation of circadian-clock period and entrainment // Neuron. - 2007. - №54. - Р. 813-829.
- Cohen S.M, Brennecke J., Stark A. Denoising feedback loops by thresholding-A new role for microRNAs // Genes & Dev. - 2006. - №20. - Р. 2769-2772.
- Gatfield D., Le Martelot G., Vejnar C.E. et al. Integration of microRNA miR-122 in hepatic circadian gene expression // Genes & Dev. - 2009. - №23. - Р. 1313-1326.
- Gonze D., Halloy J., Goldbeter A. Robustness of circadian rhythms with respect to molecular noise // Proc Natl Acad Sci USA. - 2002. - №99. - Р. 673-678.
- Katoh T, Sakaguchi Y, Miyauchi K. et al. Selective stabilization of mammalian microRNAs by 39 adenylation mediated by the cytoplasmic poly(A) polymerase GLD-2 // Genes & Dev. - 2009. - №23. - Р. 433-438.
- Kojima S., Shingle D.L., Green C. Post-transcriptional control of circadian rhythms // J Cell Sci. - 2011. - №124. - Р. 311-320.
- Lagos-Quintana M., Rauhut R., Yalcin A. et al. Identification of tissue-specific microRNAs from mouse // Curr Biol. - 2002. - №12. - Р. 735-739.
- Leloup J.C., Goldbeter A. Toward a detailed computational model for the mammalian circadian clock // Proc Natl Acad Sci USA. - 2003. - №100. - Р. 7051-7056.
- Li X, Cassidy J.J., Reinke C.A. et al. A microRNA imparts robustness against environmental fluctuation during development // Cell. - 2009. - №137. - Р. 273-282.
- Meng, F., Henson, R., Lang, M. et al. Involvement of human micro-RNA in growth and response to chemotherapy in human cholangiocarcinoma cell lines // Gastroenterology. - 2006. - №130. - Р. 2113-2129.
- Mrosovsky N., Edelstein K., Hastings M.H., Maywood E.S. Cycle of period gene expression in a diurnal mammal (Spermophilus tridecemlineatus): implications for nonphotic phase shifting // J. Biol. Rhythms. - 2001. - №16 (5). - Р. 471-478.
- Nagel R., Clijsters L., Agami R. The miRNA-192⁄194 cluster regulates the Period gene family and the circadian clock // FEBS Journal. - 2009. - №276. - Р. 5447-5455.
- O´Neill J.S., Hastings M.H. Circadian clocks: timely interference by MicroRNAs // Curr Biol. - 2007. - №17. - R760-R762.
- Pegoraro M., Tauber E. The role of microRNAs (miRNAs) in circadian rhythmicity // J. Genetics. - 2008. - №87 (5). - Р. 505-511.
- Pittendrgh C.S. Temporal organization: a reflection of a Darwinian clock-watcher // Annu. Rev. Physiol. - 1993. - №55. - Р. 16-54.
- Preitner N., Damiola F., Lopez-Molina L. et al. The orphan nuclear receptor REV-ERBa controls circadian transcription within the positive limb of the mammalian circadian oscillator // Cell. - 2002. - №110. - Р. 251-260.
- Reddy A. B., Karp N. A., Maywood E. S. et al. Circadian orchestration of the hepatic proteome // Curr. Biol. - 2006. - №16. - Р. 1107-1115.
- Sato T.K., Panda S., Miraglia, L.J. et al. A functional genomics strategy reveals Rora as a component of the mammalian circadian clock // Neuron. - 2004. - №43. - Р. 527-537
- Sun Y., Koo S., White N. et al. Development of a micro-array to detect human and mouse microRNAs and characterization of expression in human organs // Nucleic Acids Res. - 2004. - №32. - e188.
- Takahashi J.S., Hong H.K., Ko C.H., McDearmon E.L. The genetics of mammalian circadian order and disorder: implications for physiology and disease // Nat Rev Genet. - 2008. - №9. - Р. 764-75.
- Tang X, Gal J, Zhuang X, et al. A simple array platform for microRNA ***ysis and its application in mouse tissues // RNA. - 2007. - №13. - Р. 1803-1822.
- Ueda H.R., Chen W., Adachi A., et al. A transcription factor response element for gene expression during circadian night // Nature. - 2002. - №418. - Р. 534-539.
- Wienholds E., Kloosterman W.P., Miska E. et al. MicroRNA expression in zebrafish embryonic development // Science. - 2005. - №309. - Р. 310-311.
- Xu S., Witmer P.D., Lumayag S. et al. MicroRNA (miRNA) Transcriptome of Mouse Retina and Identification of a Sensory Organ-specific miRNA Cluster. // J. Biol.Chem. - 2007. - №282, 34. - Р. 25053-25066.
- Zhou W., Li Y., Wang X., Wu L., Wang Y. MiR-206-mediated dynamic mechanism of the mammalian circadian clock // BMC Systems Biology. - 2011. - №5. - Р. 141.
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
19 04 2024 5:40:21
 Статья в формате PDF
130 KB...
Статья в формате PDF
130 KB...
18 04 2024 2:22:13
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
16 04 2024 13:42:30
 Статья в формате PDF
103 KB...
Статья в формате PDF
103 KB...
15 04 2024 9:18:37
 Статья в формате PDF
112 KB...
Статья в формате PDF
112 KB...
12 04 2024 7:14:34
 Статья в формате PDF
131 KB...
Статья в формате PDF
131 KB...
10 04 2024 11:13:46
 Статья в формате PDF
108 KB...
Статья в формате PDF
108 KB...
09 04 2024 14:50:42
 Статья в формате PDF
105 KB...
Статья в формате PDF
105 KB...
08 04 2024 6:27:17
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
07 04 2024 11:25:40
 Рассмотрены основные составляющие познавательной системы профессора И.С.Мустафина, которая включает позитивное использование опыта негативных событий, а также применение оригинальных задач-рассказов и поэтического творчества для развития творческих и естественнонаучных способностей.
...
Рассмотрены основные составляющие познавательной системы профессора И.С.Мустафина, которая включает позитивное использование опыта негативных событий, а также применение оригинальных задач-рассказов и поэтического творчества для развития творческих и естественнонаучных способностей.
...
05 04 2024 12:44:41
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
03 04 2024 11:48:23
 В серии стресс-тестов исследованы особенности поведенческих реакций крыс при действии 1,5-бензодиазепинона-2 и его производных в дозах 5, 25, 50 и 100 мг/кг. В результате сравненияэтих показателейс таковыми эталонного препарата диазепама (5 мг/кг), выявлено, что под влиянием 1,5-бензодиазепинона-2 и его трех производных (4-метил-1,5-бензодиазепинон-2, 3-метил-1,5-бензодиазепинон-2, 5-формил-3-метил-1,5-бензодиазепинон-2) поведение крыс в зависимости от уровня аверсивности теста существенно изменяется. В целом установлено, что тестируемые вещества в зависимости от дозы способны проявлять психотропные (антистрессорные, анксиолитические, седативные, антидепрессантные) свойства.
...
В серии стресс-тестов исследованы особенности поведенческих реакций крыс при действии 1,5-бензодиазепинона-2 и его производных в дозах 5, 25, 50 и 100 мг/кг. В результате сравненияэтих показателейс таковыми эталонного препарата диазепама (5 мг/кг), выявлено, что под влиянием 1,5-бензодиазепинона-2 и его трех производных (4-метил-1,5-бензодиазепинон-2, 3-метил-1,5-бензодиазепинон-2, 5-формил-3-метил-1,5-бензодиазепинон-2) поведение крыс в зависимости от уровня аверсивности теста существенно изменяется. В целом установлено, что тестируемые вещества в зависимости от дозы способны проявлять психотропные (антистрессорные, анксиолитические, седативные, антидепрессантные) свойства.
...
01 04 2024 15:39:52
 Статья в формате PDF
256 KB...
Статья в формате PDF
256 KB...
31 03 2024 23:20:33
30 03 2024 21:26:42
 Статья в формате PDF
250 KB...
Статья в формате PDF
250 KB...
29 03 2024 4:42:32
 Статья в формате PDF
244 KB...
Статья в формате PDF
244 KB...
28 03 2024 17:34:38
 Статья в формате PDF
127 KB...
Статья в формате PDF
127 KB...
27 03 2024 21:14:26
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
26 03 2024 9:53:37
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
25 03 2024 2:43:59
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
24 03 2024 3:28:40
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
23 03 2024 7:14:36
 Статья в формате PDF
274 KB...
Статья в формате PDF
274 KB...
22 03 2024 8:19:12
 Статья в формате PDF
330 KB...
Статья в формате PDF
330 KB...
21 03 2024 10:19:41
20 03 2024 12:47:19
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
19 03 2024 2:50:26
 Рассматривается возможность извлечения мелкого золота из золотосодержащего речного песка при проведении очистки фарватера р. Енисей (Тува) земснарядом с производительностью 250 м³/ час по исходным пескам, и убедительно показана целесообразность и экономическая выгода этого.
...
Рассматривается возможность извлечения мелкого золота из золотосодержащего речного песка при проведении очистки фарватера р. Енисей (Тува) земснарядом с производительностью 250 м³/ час по исходным пескам, и убедительно показана целесообразность и экономическая выгода этого.
...
18 03 2024 22:16:17
17 03 2024 23:35:35
 Статья в формате PDF
152 KB...
Статья в формате PDF
152 KB...
15 03 2024 20:24:17
 Статья в формате PDF
104 KB...
Статья в формате PDF
104 KB...
14 03 2024 1:27:51
 Статья в формате PDF
312 KB...
Статья в формате PDF
312 KB...
13 03 2024 13:28:32
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
12 03 2024 6:20:50
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
11 03 2024 5:17:58
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::