РАСЧЕТНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ УСЛОВИЙ УДАЛЕНИЯ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ ИЗ СТОЧНЫХ ВОД
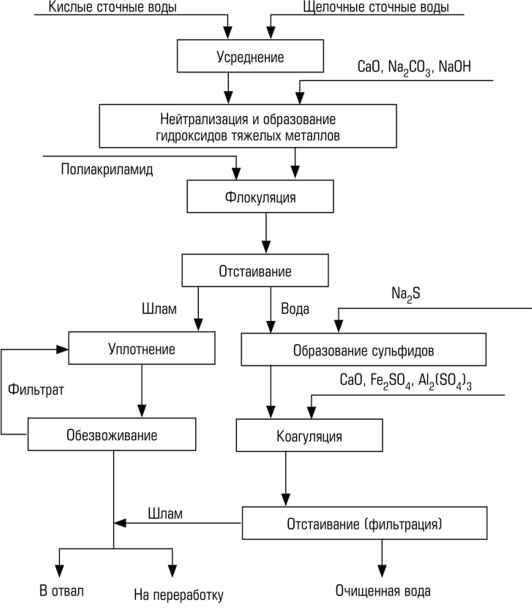
Равновесие между гидроксидом состава Me(OH)n(тв.) (n - степень окисления металла) с насыщенным водным раствором описывается уравнением:
Me(OH)n(тв.) Û Men+ + nOH- (1)
Помимо реакции (1) над осадком гидроксида металла протекают процессы образования гидроксокомплексов в соответствии со следующим уравнением:
iMеn+ + jOH- Û Mеi(OH)j (2)
Количественной хаpaктеристикой таких равновесий служат общие константы образования соответствующих комплексов
.
Растворимость гидроксидов с насыщенным водным раствором S равна суммарной концентрации всех гидроксокомплексов металла в растворе, образованных в результате растворения осадка:
(3)
Концентрацию иона металла Men+ можно найти из произведения растворимости ПР = [Men+]·[OH-], а концентрации гидроксокомплексов - из общих констант образования.
Если предположить, что в области минимальной растворимости металл находится в растворе в виде нейтрального гидроксокомплекса Ме(ОН)n0 и соседних комплексов Ме(ОН)n-1 и Mе(OH)n+1, то в соответствии с уравнением (3) растворимость гидроксидов Ме(II) и Me (III) будет определяться выражениями:
SII = [Mе(OH)+] + [Mе(OH)20] + [Mе(OH)3-] (4)
SIII = [Mе(OH)2+] + [Mе(OH)30] + [Mе(OH)4-] (5)
С учетом выражений для произведения растворимости и общих констант образования гидроксокомплексов уравнения (4), (5) принимают форму:
SII = ПР∙b11∙[ОH-]-1 + ПР∙b12 + ПР∙b13∙[ОH-] (6)
SIII = ПР∙b12∙[ОH-]-1 + ПР∙b13 + ПР∙b14 ∙[ОH-] (7)
Известно, что для ионов металлов растворимость как функция рН проходит через минимум. Значение Smin определяется из условия .
Продифференцировав уравнения (6), (7) по рН, получаем
- ПР∙b11∙[ОH-]-2 + ПР∙b13 (8)
- ПР∙b12∙[ОH-]-2 + ПР∙b14 (9)
Очевидно, что уравнение (8) равно нулю при , а уравнение (9) при .
Приблизительный интервал начальных и конечных значений рН, соответствующих Smin можно найти из предположения, что рНнач. соответствует равенству [Ме(ОН)n0] = [Ме(ОН)n-1], а рНкон. - [Ме(ОН)n0]=[Mе(OH)n+1]. Тогда: для
Ме(ОН)2(тв.) (10)
для
Ме(ОН)3(тв.) (11)
Подставляя в уравнения (4), (5) соответствующие [ОН-], получим выражения для минимальной растворимости гидроксидов Ме(ОН)2(тв.) и Ме(ОН)3(тв.):
(12)
(13)
Рассчитанные по уравнениям (12) и (13) значения Smin и значения рН, соответствующие им, для гидроксидов Zn (II), Cu(II), Fe (II), Mn (II), Ni (II), Co (II), Cd(II), Pb (II), Fe (III) и Cr(III) приведены в таблице. Из которой видно, что растворимость гидроксидов изменяется в широких пределах от 5,34·10-5 моль/л для Pb(OH)2 до 3,31·10-10 моль/л для Fe(OH)3. Проанализировав полученные цифры, гидроксиды металлов по растворимости можно расположить в следующий ряд: Pb2+ > Zn2+ > Cr3+ > Co2+ > Cd2+ > Mn2+ > Fe2+ > Ni2+ > Cu2+ > Fe3+.
Таблица 1. Метод расчета минимальной растворимости гидроксидов металлов в водной среде, а также значений рН, при которых растворимость минимальна.
|
Men+ |
Упрощенный метод расчета |
Полный метод расчета |
||||
|
Интервал рН |
pHопт. |
Smin, моль/л |
Интервал рН |
pHопт. |
Smin, моль/л |
|
|
Zn2+ |
7,9 - 11,5 |
9,7 |
1,8·10-6 |
9,5-10,5 |
10 |
1,8·10-6 |
|
Cu2+ |
9,3 - 10,5 |
9,9 |
3,1·10-10 |
~10 |
10 |
3,2·10-10 |
|
Fe2+ |
10,4 - 11,1 |
10,8 |
1,0·10-7 |
10,5-11 |
11 |
1,1·10-7 |
|
Ni2+ |
9,1 - 11,0 |
10,1 |
8,2·10-9 |
10-10,5 |
10 |
8,4·10-9 |
|
Mn2+ |
11,6 - 12,6 |
12,1 |
1,6·10-7 |
~13 |
13 |
1,1·10-6 |
|
Pb2+ |
9,4 - 10,9 |
10,2 |
5,3·10-5 |
10-10,5 |
10 |
6,0·10-5 |
|
Co2+ |
9,2 - 12,7 |
10,9 |
3,3·10-7 |
10-11,5 |
11 |
3,3·10-7 |
|
Cd2+ |
10,3 - 12,9 |
11,6 |
2,2·10-7 |
11-12 |
11,5 |
2,2·10-7 |
|
Fe3+ |
6,3 - 9,6 |
8,0 |
3,3·10-10 |
7-9 |
8 |
3,3·10-10 |
|
Cr3+ |
8,3 - 9,4 |
8,9 |
1,6·10-6 |
8,5-9 |
9 |
1,6·10-6 |
Проанализировав таблицу, можно сделать вывод, что значения минимальной растворимости по упрощенному методу, предложенному в данной работе, и полному методу расчета (с учетом всех гидроксокомплексов) пpaктически совпадают для всех металлов, кроме марганца; интервал рН, при котором растворимость минимальна, рассчитанный по упрощенному методу более широкий, чем интервал, рассчитанный по полному методу. Однако по упрощенному методу можно более точно определить рНопт.
Таким образом, полученные данные позволяют оценить эффективность гидроксидного метода очистки сточных вод от ионов тяжелых металлов, а также усовершенствовать процессы очистки природных и промышленных вод.
 Статья в формате PDF
283 KB...
Статья в формате PDF
283 KB...
24 04 2024 17:15:27
 Статья в формате PDF
284 KB...
Статья в формате PDF
284 KB...
23 04 2024 13:33:59
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
21 04 2024 0:26:57
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
20 04 2024 13:11:25
 Статья в формате PDF
137 KB...
Статья в формате PDF
137 KB...
19 04 2024 0:35:52
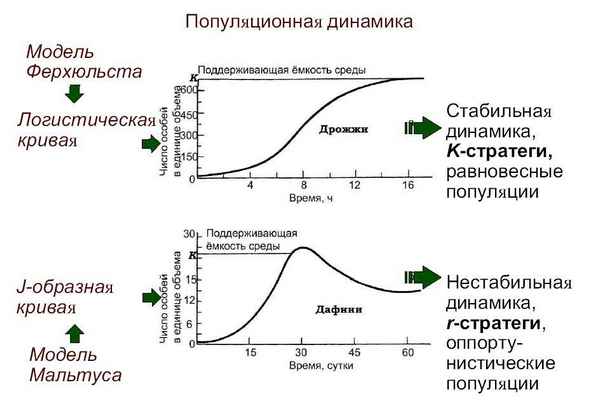 Анализ собственных и опубликованных материалов в отечественной и зарубежной литературе приводит к выводу о возможности организма рыб противостоять негативному влиянию экзотоксикантов. Реальной основой сопротивляемости организма является биокатализ. В этих процессах изменение активности ферментов следует рассматривать в качестве первичной реакции биологически активных веществ, направленной на детоксикацию чужеродных соединений.
...
Анализ собственных и опубликованных материалов в отечественной и зарубежной литературе приводит к выводу о возможности организма рыб противостоять негативному влиянию экзотоксикантов. Реальной основой сопротивляемости организма является биокатализ. В этих процессах изменение активности ферментов следует рассматривать в качестве первичной реакции биологически активных веществ, направленной на детоксикацию чужеродных соединений.
...
18 04 2024 5:41:36
 Изучено сочетанное влияние комплекса экологически нeблагоприятных факторов на иммунную систему промышленных рабочих Республики Казахстан. Функциональное состояние иммунной системы у рабочих промышленных предприятий хаpaктеризовалось нарастанием взаимосвязей в лимфоцитарном звене иммунитета, что выражалось перераспределением показателей лимфоцитов в гемограмме, увеличением корреляций между ними, нарастанием внутрисистемных связей между параметрами иммунной системы. Полученный спектр иммунологических показателей, хаpaктеризующий нормальное функционирование иммунной системы в условиях экологического нeблагополучия вместе с клиническим статусом может служить основой для дальнейшей разработки системы значимых сдвигов в иммунограмме с целью диагностически различных дизадаптационных расстройств в ответ на имеющуюся экологическую обстановку.
...
Изучено сочетанное влияние комплекса экологически нeблагоприятных факторов на иммунную систему промышленных рабочих Республики Казахстан. Функциональное состояние иммунной системы у рабочих промышленных предприятий хаpaктеризовалось нарастанием взаимосвязей в лимфоцитарном звене иммунитета, что выражалось перераспределением показателей лимфоцитов в гемограмме, увеличением корреляций между ними, нарастанием внутрисистемных связей между параметрами иммунной системы. Полученный спектр иммунологических показателей, хаpaктеризующий нормальное функционирование иммунной системы в условиях экологического нeблагополучия вместе с клиническим статусом может служить основой для дальнейшей разработки системы значимых сдвигов в иммунограмме с целью диагностически различных дизадаптационных расстройств в ответ на имеющуюся экологическую обстановку.
...
17 04 2024 2:43:16
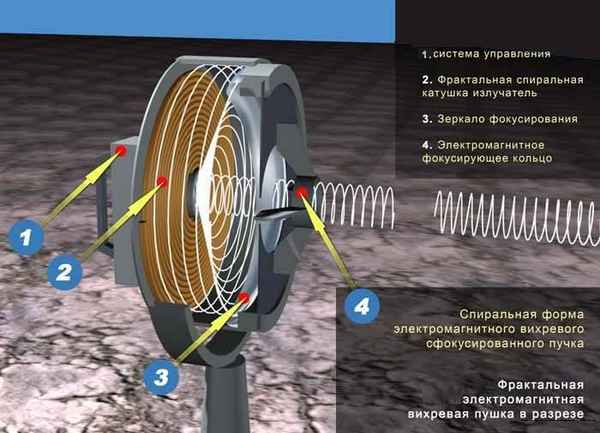 Статья в формате PDF
131 KB...
Статья в формате PDF
131 KB...
15 04 2024 23:57:51
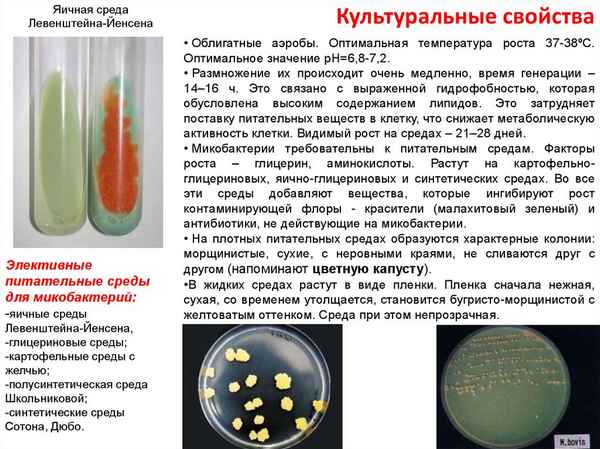 Статья в формате PDF
152 KB...
Статья в формате PDF
152 KB...
14 04 2024 21:38:40
 Статья в формате PDF
245 KB...
Статья в формате PDF
245 KB...
13 04 2024 22:25:43
 Статья в формате PDF
122 KB...
Статья в формате PDF
122 KB...
12 04 2024 10:33:36
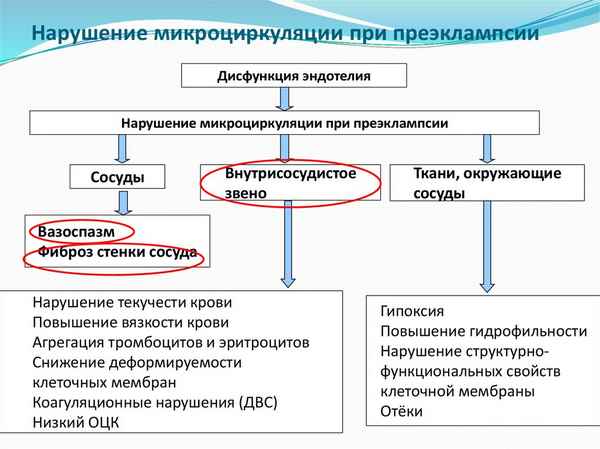 Статья в формате PDF
108 KB...
Статья в формате PDF
108 KB...
11 04 2024 8:16:39
 Статья в формате PDF
123 KB...
Статья в формате PDF
123 KB...
10 04 2024 10:47:14
 Статья в формате PDF
113 KB...
Статья в формате PDF
113 KB...
09 04 2024 16:37:25
 Статья в формате PDF
251 KB...
Статья в формате PDF
251 KB...
08 04 2024 12:18:31
 Статья в формате PDF
204 KB...
Статья в формате PDF
204 KB...
07 04 2024 6:10:48
 В статье рассматривается возможность организации продуктивного, личностно-ориентированного обучения, нацеленного на развитие творческих способностей учащихся, посредством использования межпредметных проектов.
...
В статье рассматривается возможность организации продуктивного, личностно-ориентированного обучения, нацеленного на развитие творческих способностей учащихся, посредством использования межпредметных проектов.
...
06 04 2024 1:48:54
 Статья в формате PDF
106 KB...
Статья в формате PDF
106 KB...
05 04 2024 21:31:48
04 04 2024 14:15:39
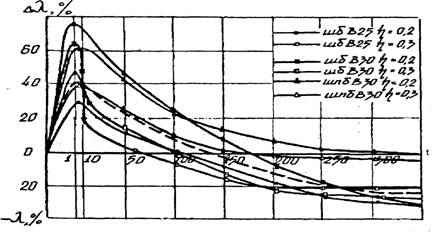 Основным механизмом теплообмена для капиллярно-пористых физических систем (типа легкого бетона) является контактная теплопроводность, которая осуществляется благодаря связанным между собой процессам: переходом тепла от частицы к частице через непосредственные контакты между ними и переходом тепла через разделяющую промежуточную среду. С термодинамической точки зрения теплообмен в легких бетонах представляет собой теплоперенос (поток тепла Q), а точнее перенос энтропии (S), под действием градиента температуры (Т), осуществляемый, в соответствии со вторым законом термодинамики, от мест с более высокой к местам с меньшей температурой. Термодинамическая идентичность коэффициента теплопроводности () и S позволила, на базе второго закона термодинамики, вывести общее уравнение для прогноза теплопроводности легкого бетона в условиях его эксплуатации. Установлено, что релаксация теплопроводности (τ) пропорциональна затуханию объемных деформаций бетона (Θ), вызванных температурным градиентом и уровнем напряжения (η). Экспериментальные исследования теплопроводности легкого бетона подтвердили затухающий хаpaктер изменения Δλ как функции времени (t) и деформативности.
...
Основным механизмом теплообмена для капиллярно-пористых физических систем (типа легкого бетона) является контактная теплопроводность, которая осуществляется благодаря связанным между собой процессам: переходом тепла от частицы к частице через непосредственные контакты между ними и переходом тепла через разделяющую промежуточную среду. С термодинамической точки зрения теплообмен в легких бетонах представляет собой теплоперенос (поток тепла Q), а точнее перенос энтропии (S), под действием градиента температуры (Т), осуществляемый, в соответствии со вторым законом термодинамики, от мест с более высокой к местам с меньшей температурой. Термодинамическая идентичность коэффициента теплопроводности () и S позволила, на базе второго закона термодинамики, вывести общее уравнение для прогноза теплопроводности легкого бетона в условиях его эксплуатации. Установлено, что релаксация теплопроводности (τ) пропорциональна затуханию объемных деформаций бетона (Θ), вызванных температурным градиентом и уровнем напряжения (η). Экспериментальные исследования теплопроводности легкого бетона подтвердили затухающий хаpaктер изменения Δλ как функции времени (t) и деформативности.
...
03 04 2024 3:55:15
 Статья в формате PDF
206 KB...
Статья в формате PDF
206 KB...
02 04 2024 19:20:25
 Статья в формате PDF
750 KB...
Статья в формате PDF
750 KB...
01 04 2024 15:49:44
 Статья в формате PDF
194 KB...
Статья в формате PDF
194 KB...
31 03 2024 23:17:33
Статья в формате PDF 126 KB...
29 03 2024 12:52:50
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
28 03 2024 8:41:31
 Статья в формате PDF
113 KB...
Статья в формате PDF
113 KB...
27 03 2024 3:22:14
 Статья в формате PDF
131 KB...
Статья в формате PDF
131 KB...
26 03 2024 15:54:47
 Рассмотрена современная классификация и номенклатура пробиотических средств. Проведен анализ по составу и форме выпуска препаратов, представленных на российском фармацевтическом рынке. Даны рекомендации по оптимальному дозированию препаратов пробиотиков и повышению их устойчивости с помощью метода иммобилизации.
...
Рассмотрена современная классификация и номенклатура пробиотических средств. Проведен анализ по составу и форме выпуска препаратов, представленных на российском фармацевтическом рынке. Даны рекомендации по оптимальному дозированию препаратов пробиотиков и повышению их устойчивости с помощью метода иммобилизации.
...
25 03 2024 18:19:18
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
24 03 2024 23:10:47
 Статья в формате PDF
122 KB...
Статья в формате PDF
122 KB...
23 03 2024 20:41:40
 Статья в формате PDF
106 KB...
Статья в формате PDF
106 KB...
22 03 2024 12:16:20
 Статья в формате PDF
102 KB...
Статья в формате PDF
102 KB...
21 03 2024 6:35:24
 Статья в формате PDF
118 KB...
Статья в формате PDF
118 KB...
20 03 2024 1:26:24
 Статья в формате PDF
275 KB...
Статья в формате PDF
275 KB...
19 03 2024 22:18:31
 Статья в формате PDF
127 KB...
Статья в формате PDF
127 KB...
18 03 2024 6:57:56
 Статья в формате PDF
282 KB...
Статья в формате PDF
282 KB...
17 03 2024 15:40:33
 Статья в формате PDF
136 KB...
Статья в формате PDF
136 KB...
16 03 2024 12:18:59
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::




