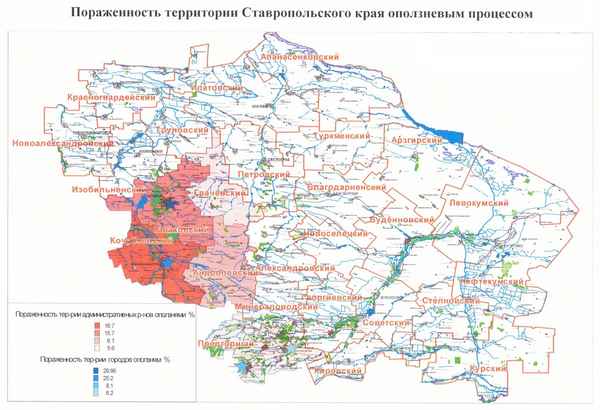
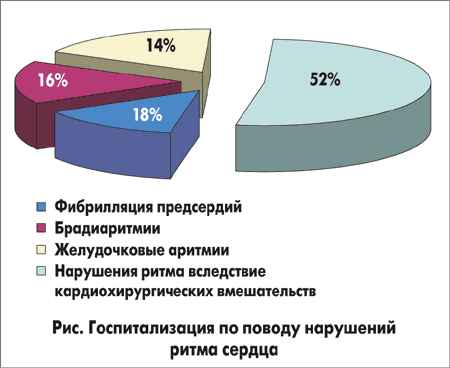
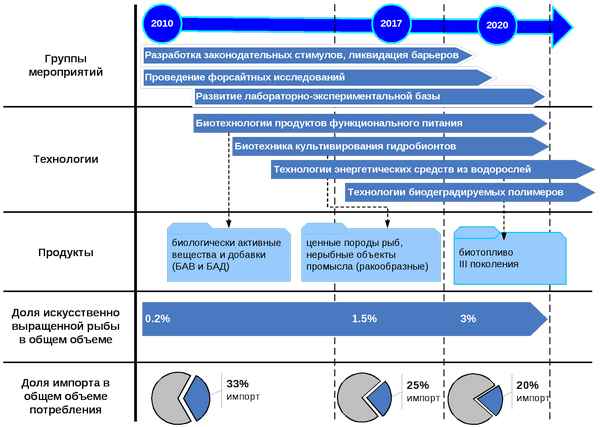
ОБ УСТОЙЧИВОСТИ СОСТОЯНИЙ ЛОКАЛЬНОГО ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ РАСТВОРОВ ПРИ ФАЗОВЫХ ПЕРЕХОДАХ

В данной статье авторы ограничились изучением и привлечением экспериментального материала, полученного другими исследователями, для анализа математических формулировок состояния локального термодинамического равновесия растворов при фазовых переходах в многолетнемерзлых горных породах.
Так, в работе [1] в качестве условия локального термодинамического равновесия для двухфазной зоны, определяющее взаимосвязь между температурой Т и концентрацией раствора С, рассматривается выражение следующего вида:
T=T0 - η (C - C0) (1)
В качестве определяющей гипотезы, теоретически допускающей ее применение, авторы предполагали, что эвтектика раствора может не достигаться, а должна обеспечиваться выбором соответствующих граничных условий [1]. В инженерной пpaктике применение соотношения (1) давно апробировано и применяется для нейтральных растворов, а в случае применения для электролитов необходимо вводить поправочные коэффициенты. Например, часто рекомендуется применять формулу для расчета температуры замерзания раствора. Причем для оценки ΔT считается достаточной применить выражение типа ΔT=Kf •m . Здесь Кf - коэффициент, имеющий смысл криоскопической постоянной растворителя, понимается понижение температуры замерзания раствора при растворении 1 гмоль вещества на 1 кг растворителя; m - моляльность растворенного вещества (число молей растворенного вещества на 1 кг растворителя). Например, для воды коэффициент Кf равен 1,86 К.
Воспользовавшись классическим приближением (закон Рауля) для определения понижения температуры замерзания раствора проведем небольшое исследование. Учитывая, что природные растворы могут быть сильными электролитами, вывод расчетных выражений и численные оценки будут вестись так, чтобы без существенного изменения исходных формул, иметь возможность вносить квазиклассические поправки [2].
В качестве необходимых условий термодинамического равновесия раствора постулируем:
А) Изменение импульса локального объема раствора равно нулю ; где m - масса элементарного, локального объема раствора; - скорость раствора.
Б) Флуктуации термодинамических параметров системы считаем пренебрежимо малыми при рассмотрении локального термодинамического равновесия раствора при фазовых переходах
Здесь (L1)3 - элементарный физический объем; V - объем на одну частицу; ai - макроскопические параметры системы; τL2 - хаpaктерное время релаксации системы; τL1 - хаpaктерное время релаксации в объеме на одну частицу; τ - время релаксации в элементарном объеме.
В) Определяющее уравнение локального равновесия имеет вид:
.
При указанных условиях исследуем равновесие системы, состоящей из К = 2 компонент [растворимое вещество - соль (например, NaCl), растворитель - Н2О] и r = 2 фазы. Согласно правилу фаз Гиббса данная система обладает количеством степеней свободы равной . Следовательно, из четырех переменных Т, Р, Сж., Ств произвольные значения могут принимать только два параметра. Т.е. если заданы Сж (концентрация растворенного вещества в жидкой фазе) и Ств ( тоже в твердой фазе), то переменными величинами являются температура и давление.
Условие локального термодинамического равновесия означает равенство химических потенциалов в точке фазового перехода. Запишем это следующим образом:
(2)
где - химический потенциал воды; - химический потенциал льда.
Понятно, что для воды при отсутствии в ней растворенного вещества Сж = Ств = 0 равенство химических потенциалов будет иметь вид:
. (3)
На кривой локального термодинамического равновесия фаз температуре замерзания раствора ТЕ соответствует давление РЕ = Р(ТЕ).
Разложим химический потенциал μ в ряд Тейлора в точке замерзания раствора и удержим только первые три его члeна.
(4)
Теперь, разложим условие локального равновесия (2), используя выражение (4) для химического потенциала:
(5)
Учитывая, что энергия Гиббса и химический потенциал связана между собой выражением , найдем:
,
. (6)
Подставим (6) в (5) получим:
(7)
Скрытая теплота в точке фазового перехода определяется через энтальпию следующим образом:
. (8)
Тогда, условие локального термодинамического равновесия (7) будет иметь вид:
(9)
При свободном замерзании раствора и если растворимое вещество не вымерзает градиент понижения температуры замерзания раствора определиться в виде:
. (10)
Концентрация растворенного вещества в жидкости определяется через отношение числа молекул растворителя и растворенного вещества. Отнеся теплоту плавления к 1 Кмоль, получаем:
. (11)
Например, если растворим 15 г соли NaCl в 1 л воды, то температура понижения замерзания раствора будет равна:
.
Водный раствор NaCl обладает свойствами электролита в зависимости от концентрации. Поэтому необходимо внести в выражение (11) поправочный множитель Дебая-Хюккеля, учитывающий взаимодействие ионов в электролите. При выводе поправки Дебая учитывалась только кулоновская часть термодинамического потенциала:
. (12)
Тогда для водного раствора NaCl заданной концентрации для условий предыдущего примера получим:
Поправка Дебая для температуры ΔТ в нашем случае дает два корня m1 = 0 и m2 = 416,2. В действительности, поправка Дебая работает только до точки экстремума (m = 184,9 и ΔТ = -3,9). Учет химической поправки может быть выполнен либо построением эмпирического термического уравнения состояния, либо расчетом фазового интеграла Гиббса.
Из условия локального равновесия непосредственно следует уравнение Гиббса для энтропии:
. (13)
Обозначим максимальную энтропию системы через величину Smax . Применим термодинамическую теорию возмущений к данной системе вблизи точки Smax . Хаpaктерное условие будет иметь вид:
.
В этом случае устойчивость энтропии системы будет определяться вариацией энтропии второго порядка δ2S , т.к. члeн первого порядка при приближении функции к максимальному значению обращается в нуль. Тогда, условие устойчивости имеет вид: .
Проанализируем уравнение Гиббса с помощью метода возмущения. Так как энтропия является аддитивной величиной, то каждую переменную уравнения рассмотрим отдельно, а общий результат суммируем. Тогда, критерий термодинамической устойчивости системы примет вид квадратичной формы:
(14)
где cu - теплоемкость; ρ - плотность; Χ - изотермическая сжимаемость; Ni - мольная доля компоненты i. Индекс Ny означает, что при вариации Ny состав раствора остается постоянным.
Основные условия устойчивости термодинамического равновесия подразделяются на следующие виды:
- тепловая устойчивость;
- механическая устойчивость;
- диффузионная устойчивость.
Физический смысл условий очевиден. Например, если нарушается тепловое условие устойчивости, то это приведет согласно уравнению Фурье не к затуханию, а к росту флуктуаций. Основное достоинство критерия (14) в его универсальности применения к растворам различного типа в мерзлых горных породах и грунтах.
Литература
- Петров Е.Е., Мордовской С.Д. Методы прогноза термомеханического состояния массива многолетнемерзлых горных породах. Якутск: ЯГУ, 1995. - 48 с.
- Ландау Л., Лифшиц Е. Статистическая физика. М.: Изд-во технико-теоретической литературы, 1951.- 480 с.
 Статья в формате PDF
108 KB...
Статья в формате PDF
108 KB...
24 04 2024 16:46:48
 Общеобразовательный процесс включает в себя множество учебных дисциплин, формирующих мышление учащихся, в том числе и естественнонаучные дисциплины. Гимназическое образование в современной жизни формирует у учащихся личностные качества, ценностные ориентиры, социально значимые знания, отвечающие динамичным изменениям социума и необходимые для организации самостоятельной достойной жизни.
...
Общеобразовательный процесс включает в себя множество учебных дисциплин, формирующих мышление учащихся, в том числе и естественнонаучные дисциплины. Гимназическое образование в современной жизни формирует у учащихся личностные качества, ценностные ориентиры, социально значимые знания, отвечающие динамичным изменениям социума и необходимые для организации самостоятельной достойной жизни.
...
23 04 2024 9:48:23
 Статья в формате PDF
456 KB...
Статья в формате PDF
456 KB...
22 04 2024 7:43:10
 Статья в формате PDF
136 KB...
Статья в формате PDF
136 KB...
21 04 2024 15:32:23
 Статья в формате PDF
187 KB...
Статья в формате PDF
187 KB...
18 04 2024 2:36:44
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
17 04 2024 21:36:36
 Статья в формате PDF
102 KB...
Статья в формате PDF
102 KB...
16 04 2024 19:51:59
 Статья в формате PDF
334 KB...
Статья в формате PDF
334 KB...
15 04 2024 15:45:38
 Изучены показатели иммунной системы у 36 пациенток с хроническим рецидивирующим кандидозным вульвовaгинитом в период обострения заболевания. Контрольную группу составили 36 здоровых женщин. Выявлен дисбаланс клеточного иммунитета при одновременном снижении функциональной активности гумopaльного звена иммунитета.
...
Изучены показатели иммунной системы у 36 пациенток с хроническим рецидивирующим кандидозным вульвовaгинитом в период обострения заболевания. Контрольную группу составили 36 здоровых женщин. Выявлен дисбаланс клеточного иммунитета при одновременном снижении функциональной активности гумopaльного звена иммунитета.
...
14 04 2024 21:11:36
 Статья в формате PDF
205 KB...
Статья в формате PDF
205 KB...
13 04 2024 11:58:42
 Статья в формате PDF
252 KB...
Статья в формате PDF
252 KB...
12 04 2024 5:27:12
 Статья в формате PDF
106 KB...
Статья в формате PDF
106 KB...
11 04 2024 14:15:24
 Статья в формате PDF
425 KB...
Статья в формате PDF
425 KB...
10 04 2024 13:33:40
 Статья в формате PDF
664 KB...
Статья в формате PDF
664 KB...
09 04 2024 15:20:14
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
08 04 2024 13:36:22
 Статья в формате PDF
112 KB...
Статья в формате PDF
112 KB...
07 04 2024 4:56:33
 Статья в формате PDF
256 KB...
Статья в формате PDF
256 KB...
06 04 2024 12:11:11
 Статья в формате PDF
132 KB...
Статья в формате PDF
132 KB...
05 04 2024 9:32:53
 Статья в формате PDF
264 KB...
Статья в формате PDF
264 KB...
04 04 2024 12:56:34
 В работе освещены современные представления о питании беременных женщин. Описаны возможные осложнения при нарушении пищевого статуса перед вступлением в бpaк. Показаны пути коррекции питания беременных женщин в первые периоды беременности, которые используются в России и в развитых западных странах.
...
В работе освещены современные представления о питании беременных женщин. Описаны возможные осложнения при нарушении пищевого статуса перед вступлением в бpaк. Показаны пути коррекции питания беременных женщин в первые периоды беременности, которые используются в России и в развитых западных странах.
...
02 04 2024 10:32:15
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
01 04 2024 22:55:51
 Статья в формате PDF
119 KB...
Статья в формате PDF
119 KB...
30 03 2024 6:38:13
 Статья в формате PDF
103 KB...
Статья в формате PDF
103 KB...
29 03 2024 19:15:40
 Статья в формате PDF
262 KB...
Статья в формате PDF
262 KB...
28 03 2024 11:29:25
 В данной работе предложен принципиально новый подход нахождения справедливой цены опциона европейского типа при условии дискретности хеджирования на эффективном рынке базового актива. Развитый подход позволяет определить стоимость опциона для достаточно широкого класса распределений цены базового актива, не ограничиваясь гипотезой о том, что распределение цен базового актива подчиняется логнормальному закону. Анализ полученных результатов позволил утверждать, что существуют такие состояния рынка, при которых осуществить хеджирование не предоставляется возможным. Данный эффект не находится в противоречии с теорией Блэка-Шоулза, т.к. конфигурация областей «нехеджируемости» вырождается в пустое множество при достаточно большом количестве актов хеджирования и достаточно малом промежутке времени между актами хеджирования
...
В данной работе предложен принципиально новый подход нахождения справедливой цены опциона европейского типа при условии дискретности хеджирования на эффективном рынке базового актива. Развитый подход позволяет определить стоимость опциона для достаточно широкого класса распределений цены базового актива, не ограничиваясь гипотезой о том, что распределение цен базового актива подчиняется логнормальному закону. Анализ полученных результатов позволил утверждать, что существуют такие состояния рынка, при которых осуществить хеджирование не предоставляется возможным. Данный эффект не находится в противоречии с теорией Блэка-Шоулза, т.к. конфигурация областей «нехеджируемости» вырождается в пустое множество при достаточно большом количестве актов хеджирования и достаточно малом промежутке времени между актами хеджирования
...
27 03 2024 20:22:57
 Статья в формате PDF
108 KB...
Статья в формате PDF
108 KB...
26 03 2024 15:25:15
 Статья в формате PDF
153 KB...
Статья в формате PDF
153 KB...
24 03 2024 19:24:30
 Статья в формате PDF
251 KB...
Статья в формате PDF
251 KB...
23 03 2024 1:16:50
 Статья в формате PDF
312 KB...
Статья в формате PDF
312 KB...
22 03 2024 11:50:26
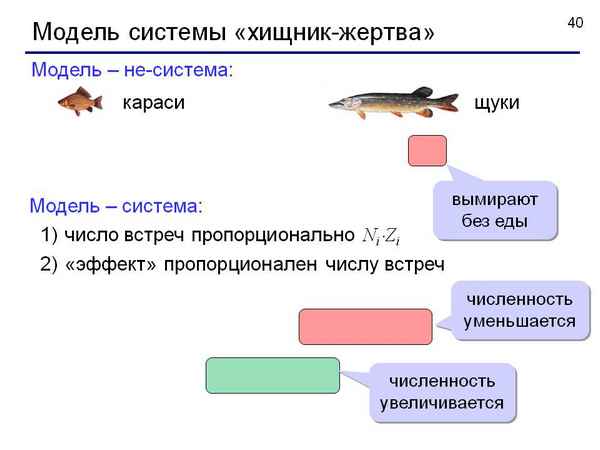 В настоящей работе рассматриваются сложные иерархические системы «хищник -жертва - продуцент». В основу исследования таких систем положены достаточно хорошо известные экспериментальные данные, собранные компанией «Гудзонов залив» за более чем столетний период. На нижнем уровне сложной иерархической системы исследуется влияние солнечного потока на скорость роста продуцентов (деревьев, кустарников и т.д.). Показана возможность стохастических колебаний в многоуровневой системе. Подтверждена ранее высказанная гипотеза о возможности колебаний в системе «жертва -продуцент». Математическая модель описывает широкий спектр процессов и явлений, которые хаpaктерны для сложных экологических систем.
...
В настоящей работе рассматриваются сложные иерархические системы «хищник -жертва - продуцент». В основу исследования таких систем положены достаточно хорошо известные экспериментальные данные, собранные компанией «Гудзонов залив» за более чем столетний период. На нижнем уровне сложной иерархической системы исследуется влияние солнечного потока на скорость роста продуцентов (деревьев, кустарников и т.д.). Показана возможность стохастических колебаний в многоуровневой системе. Подтверждена ранее высказанная гипотеза о возможности колебаний в системе «жертва -продуцент». Математическая модель описывает широкий спектр процессов и явлений, которые хаpaктерны для сложных экологических систем.
...
21 03 2024 3:33:21
20 03 2024 23:33:45
 Статья в формате PDF
301 KB...
Статья в формате PDF
301 KB...
19 03 2024 1:11:15
Статья в формате PDF 126 KB...
18 03 2024 23:32:34
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::