ПЛАЦЕНТАРНАЯ ЩЕЛОЧНАЯ ФОСФАТАЗА – МАРКЕР ЭМБРИОНАЛЬНЫХ И МАЛИГНИЗИРОВАННЫХ ТКАНЕЙ

Плацентарную щелочную фосфатазу (ПЩФ), источником которой в организме матери является плацента [12], относят к белкам, ассоциированным с беременностью и опухолевым ростом [1, 13, 15, 31, 36]. ПЩФ генетически полиморфна и, в отличие от других типов щелочной фосфатазы, выдерживает нагревание до 65 °С в течение 10-15 минут и ингибируется в высокой степени L-фенилаланином и незначительно - L-гомоаргинином, но не L-лейцином, мочевиной и ЭДТА [13, 16, 18, 19]. Обычно ПЩФ синтезируется в плацентарном синцитиотрофобласте и поступает в кровоток матери после 12 недель беременности в количестве от 1,0 до 40,0 Ед/л. Различают 6 общих фенотипов ПЩФ S, FS, F, I, SI и FI согласно их изоэлектрической подвижности в крахмальном геле: S - медленная, F - быстрая и I - промежуточная [15, 18, 31]. Три общих аллеля ответственны за 97,5 % плацентарных фенотипов, в связи с чем, частота редких аллелей достигает 2,5 %. Это приводит к появлению редких гибридных фенотипов. Так, при исследовании 5000 плацент разных рас людей выявлено 48 фенотипов ПЩФ [1, 9, 22]. Ещё большее многообразие вариантов ПЩФ может быть выявлено с помощью моноклональных антител [14, 24]. Исследование ДНК и энзимного полиморфизма ПЩФ используется при изучении популяционных отличий [9, 22, 24, 31].
В онтогенезе экспрессия ЩФ регулируется таким образом, что до 10-й недели беременности в плаценте присутствует ЩФ, похожая по свойствам на печеночную ЩФ взрослого человека, на 10-13 неделях удаётся обнаружить плацентарный изоэнзим, а к 14 неделям этот фермент обеспечивает полную активность ЩФ плаценты, причём синтез его стимулируется эстрогенами [1, 11, 16, 26]. Вероятно, печёночная ЩФ является филогенетически более древней, а плацентарная ЩФ - более поздним продуктом эволюции, т.к. встречается только у некоторых приматов и человека [6, 31].
Промежуточное положение занимает схожая с ПЩФ по аминокислотному составу, антигенным свойствам и чувствительностью к L-фенилаланину, но менее термостабильная тонкокишечная ЩФ (ТКЩФ) человека. Обнаружены гибриды ПЩФ-ТКЩФ [11, 15, 24].
В наших исследованиях методом встречного иммуноэлектрофореза (ВИЭФ), с использованием моноспецифической кроличьей антисыворотки к ПЩФ и последующим гистохимическим окрашиванием агаровых пластинок на щелочную фосфатазу, ПЩФ определяется как в водно-солевых экстpaктах на трис-глициновом буфере рН 8,6 (титр 1:512), так и бутаноловых экстpaктах плаценты. При этом наибольшее количество фермента экстрагируется бутанолом из её мембранных фрагментов (титр 1:2048). Это также свидетельствует о существовании секретируемой и мембраносвязанной форм ПЩФ [1, 5, 6, 7, 33, 34]. Секретируемая ПЩФ выявляется в водно-солевых экстpaктах фетальной лёгочной ткани с 26 недель внутриутробного развития плода человека в 72,7 % случаев в титре 1/4-1/8 (4-8 ЕД). К моменту рождения частота обнаружения этого антигена снижается до 30 % (титр 1/2-1/4 или 2-4 ЕД). Мембраносвязанная ПЩФ обнаруживается в бутаноловых экстpaктах эмбриональных органов человека: в лёгких печени, почках, ЖКТ. Кроме того, кроличья антисыворотка, полученная к бутаноловым экстpaктам из мембранной фpaкции фетального лёгкого, даёт реакцию полной идентичности с антисывороткой к ПЩФ [6], что является ещё одним доказательством продукции ПЩФ в эмбриональной легочной ткани. Высокая активность ПЩФ выявляется также иммуногистохимическим методом в зоне активного новообразования костной ткани эмбрионов человека: зона роста, периостальный слой и эндотелий новообразующихся сосудов и гаверсовых каналов [7, 34].
В сыворотке крови и органах здоровых взрослых людей методом ВИЭФ ПЩФ не идентифицируется [6, 8], однако, минорные количества ПЩФ определяются в сыворотке крови более чувствительными иммуноферментными и иммунорадиологическими методами, как у здоровых небеременных женщин, так и у мужчин, значительно повышаясь при патологии [3, 10, 16, 17, 27, 31, 34].
ПЩФ синтезируется в течение всей беременности, однако её физиологическая роль неясна [2, 7, 20, 21, 26, 31, 36]. По данным Onwuameze I.C. et al, (метод иммуноферментного анализа) у 47 небеременных средняя концентрация ПЩФ равна 0,79 ± 1,54 МЕ/л и в первые 8 недель беременности (98 женщин) достоверных отличий не отмечено (0,98 ± 1,28 МЕ/л). В процессе развития беременности уровень ПЩФ нарастает и её определение может быть рекомендовано в качестве простого теста для определения плацентарной недостаточности [2, 26]. В отдельных случаях количество ПЩФ в сыворотке крови здоровых беременных может превышать нормальный уровень в 10-25 раз [36]. Снижение уровня ПЩФ в крови беременных отмечено при гестозах, нарушении кальций-фосфор-магниевого гомеостаза, угрозе прерывания беременности[1, 2, 5, 19], а повышение - при диабете беременных [37].
Мы выявили ПЩФ в сыворотке крови у 6,4 % беременных женщин на 3-4 неделях беременности (метод ВИЭФ). К моменту родов (10 месяцев) у всех женщин (100 %) в сыворотке крови ПЩФ присутствует в количестве 8-16 ЕД Боданского (до 20-32 ЕД - в отдельных случаях). При этом выявляются, как правило, обе изоформы ПЩФ - F и S. Диапазон титра колeблется от 4 до 8 ЕД в 88 % случаев, что определено нами как количество ПЩФ, необходимое для нормального протекания беременности. К моменту родов количество ПЩФ увеличивается в большинстве случаев в 2 раза (титр до 16-32 ЕД), что также, вероятно, является показателем компенсированного гомеостаза в системе «мать-плод»[1, 5, 6, 7].
Мы впервые обнаружили ПЩФ в крови родильниц, где она определяется в титре 1/8-1/32 до момента выписки из стационара (8-14 дней). При изучении сывороток крови 26 женщин в более отдаленные сроки постнатального периода (через месяц после родов и более) методом ВИЭФ мы не выявили в них ПЩФ[1].
Таким образом, функция ПЩФ в организме матери представляется неоднозначной. Видимо, этот энзим, участвуя в дефосфорилировании различных соединений, является активным ключевым ферментом многих метаболических процессов в быстрорастущих тканях матери и плода, для обеспечения которых обычных гидролаз было бы недостаточно [9, 19, 20, 21, 26, 29, 33]. Кроме того, ПЩФ принимает участие в активации факторов роста и, возможно, сама обладает такими свойствами [30]. Есть также указания на то, что ПЩФ может играть роль активатора плазминогена, что очень важно для регуляции системы гемостаза беременных и рожениц, у которых, как правило, отмечается гиперкоагуляция [7]. В физиологических условиях ПЩФ, наряду с ХГЧ, плацентарным лактогеном, специфическим бета-гликопротеином беременных и антигеном KI - 67, относят к маркёрам дифференцировки трофобласта [23, 25, 28]. Как отмечают Losh A. et Kainz C. [23] клиническое распознавание различий между полным и частичным пузырным заносом (complete hydatidiform mole and partial hydatidiform mole) позволяет прогнозировать повторное развитие беременности, малигнизацию или метастазирование трофобластической болезни беременных. Solehnia M. et al. не опровергают это положение, обнаружив снижение активности ПЩФ в ткани плаценты и сыворотке крови женщин с полным пузырным заносом [28]. ПЩФ может способствовать развитию плода, также как и росту paковых клеток, которые экспрессируют онкоген Ras [24, 30].
Интерес к ПЩФ в oнкoлoгии возник после того, как Fishman W. в 1968 г. обнаружил в ткани аденокарциномы лёгкого, плевральном экссудате и сыворотке больного paком лёгкого термостабильную щелочную фосфатазу, иммунохимически идентичную плацентарной, которую он назвал по имени больного «изоэнзим Регана» [16].
С тех пор обнаружено, что злокачественные опухоли могут продуцировать и другие варианты ПЩФ. Отмечена продукция опухолевыми тканями раннего плацентарного изоэнзима («не Регана»), хаpaктерного для плаценты первых 6 - 10 недель беременности [31], «изоэнзима Нагао» а также тонкокишечного варианта ЩФ («Казахара»), дающим перекрёстную реакцию преципитации с антисывороткой к ПЩФ [15]. Этот изофермент ингибируется L-фенилаланином, L-гомоаргинином, устойчив к нагреванию при 56 °С, но не к 65 °С и обнаруживается в сыворотке крови больных гепатомой , почечно-клеточным paком, семиномой и paком поджелудочной железы [11, 13, 15, 16, 17, 18, 19, 20, 26, 33, 35].
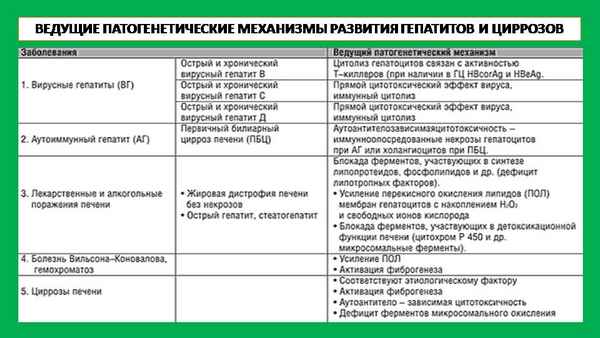
При заболеваниях печени (гепатит, цирроз) возрастает количество кишечного изофермента ЩФ, дающего перекрёстную иммунохимическую реакцию с плацентарной ЩФ [6, 8, 15, 18]. При злокачественных опухолях печени в крови определяются печёночная и плацентарная ЩФ [8, 16, 18, 24, 31, 32]. По нашим данным, изоэнзимы ПЩФ обнаруживаются в опухолевой, околоопухолевой легочной ткани и коже больных paком легких иммуногистохимическими методами в 61-70 % случаев, что ассоциируется с существованием в клинической картине paка паранеопластических синдромов. При этом, количество активного изоэнзима в 8 раз выше в тканях низкодифференцированного или недифференцированного paка легкого, по сравнению с высокодифференцированным, что может быть использовано в иммуноморфологической хаpaктеристике этого заболевания [6, 34]. Появление ПЩФ и ПШФ-подобных изоэнзимов в сыворотке крови мы регистрировали методом ВИЭФ в количестве 1-8 ЕД у 52,7 % больных с 3 и 4 стадиями paка легкого и лишь в 5,3 % случаев - при 1 и 2 стадии, что может служить дополнительным диагностическим и прогностическим признаком [1, 6]. Кроме того, ПЩФ считается маркёром герминогенных опухолей и обнаружение её при paке легкого и других локализациях, на наш взгляд, следует учитывать при разработке схем химио-гормонотерапии
[4, 10, 27, 35].
Изоэнзимам ПЩФ, как опухолевым маркёрам, посвящено большое число публикаций, в том числе, фундаментальных обзоров и монографий [16, 24, 31]. Согласно гипотезе, объясняющей синтез неопластической клеткой белков, не свойственных данному типу клеток в норме, этот процесс является следствием депрессии генома, сопровождающего неопластическую трaнcформацию [16, 24, 31]. Установлено, что ПЩФ обнаруживается в злокачественных опухолях гортани, пищевода, желудка, толстой кишки, печени, простаты, яичек и яичников. При этом ПЩФ является маркёром определённых клеток трофобласта, желточного мешка и зародышевых клеток, которые, при возникновении из них опухолевых линий, продуцируют значительные количества этого энзима, что может быть использовано в уточняющей диагностике, контроле лечения и мониторинге заболевания [4, 6, 10, 24, 25, 28].
Список литературы
- Беда Н.А. Плацентарная щелочная фосфатаза и острофазовые белки в иммунохимической оценке течения беременности и некоторой онкопатологии: дис. ... канд. мед. наук. - М., 2002. - С. 9-27.
- Бурлев В.А., Зайдиева З.С., Тютюник В.Л., Лапшина И.И. Клинико-диагностическое значение плацентарной щелочной фосфатазы у беременных // Проблемы репродукции,. - 2000. - №5. - URL: 7. http://rusmedserv.com/article/articleprint/335/-1/47.
- Громышевская Л.Л., Татьяноко Н.В., Радзевич И..М. и др. Изоферменты щелочной фосфатазы: клиническое и экспериментальное исследование при остром гепатите, циррозе, обтурационной желтухе // Успехи гепатологии / под ред. А.Ф. Блюгера. - Рига, 1980. - Вып. 8. - С. 145-164.
- Мацко Д.Е., Иванцов А.О. Патологическая анатомия герминогенных опухолей // Пpaктическая oнкoлoгия. - 2006. - Т.7, №1. - С. 6-15.
- Москаленко Н.П. Иммунохимическое исследование плацентарной щелочной фосфатазы у беременных женщин при поздних гестозах: дис. ... канд. мед. наук. - М., 2005. - С. 22-28.
- Сухарев А.Е. Тканевые и сывороточные острофазовые белки в клинической оценке неспецифических заболеваний и paка легких: автореф. дис. ... докт. мед. наук. - М., 1992. - 28 с.
- Сухарев А.Е., Вайчулис Ю.В., Асфандияров Р.И., Л.Ф. Панченко и др. Плацентарная щелочная фосфатаза и острофазовые белки в клинико-лабораторной оценке факторов повышенного геморрагического риска в акушерстве: монография. - М.-Астpaxaнь, 2006. - С. 44-67.
- Сухарев А.Е., Яценко К.С., Богодух В.И., Вайчулис Ю.В. Определение изоэнзимов плацентарной щелочной фосфатазы методом встречного иммуноэлектрофореза в сыворотках крови больных гепатобилиарной патологией // Лабор. Дело. - 1987. - № 8. - С. 572-574.
- Bekman G., Vennberg K., Bekman L. et al. Polymorphism of placental alkaline phosphatase on the level of DNA and protein in the Mordovian population // Genetika. - 1996. - Mar. Vol. 32, № 3. - P. 420-4.
- Ben-Arie A., Ha*** Z., Ben-Hur H. et al. Elevated serum alkaline phosphatase may enable early diagnosis of ovarian cancer // Eur.J.Obstet.Gynecol.Reprod.Biol. - 1999. - Vol. 86, № 1. - P. 69-71.
- Bentouati L., Samadi M., Hachem H. et al. Hyperphosphatasemia related to three intestinal alkaline phosphatase isoforms: biochemical study // Clinica Chimica Acta. - 1990. - № 189. - P. 145-152.
- Berger J., Micanovic R., Greenspan R.J., Udenfriend S. Conversion of placental alkaline phosphatase from a phosphatidylinositolglycan-anchored protein to an integral transmembrane protein // Proc. Natl. Acad. Sci. USA. - 1989. - № 86. - P. 1457-1460.
- De Broe M., Pollet D. Multicentr Evaluation of Human Placental Alkaline Phosphatase as a Possible Tumor-Associated Antigen in Serum // Clinical Chemistry. - 1988. - № 34. - P. 10-16.
- De Voorde A., De Groote G., De Waele F. et al. Screening of sera and tumor extracts of cancer patients using monoclonal antibody directed againts human placental alkaline phosphatase // Eur. J. Cancer Clin. Oncol. - 1985. - Vol. 21, № 1. - P. 65-71.
- Endo T., Higashino K., Hada T. Et al. Structures of the Asparagine-linked Oligosas-charides of an Alkaline Phosphatase, Kasahara Isozyme, Purified from FL Amnion Cells // Cancer Resaarch. - 1990. - № 50. - P. 1079-1084.
- Fishman W.H., Singer R.W. Ectopic Isoenzymes. Expression of Embryonic Genes in Neoplasia // Cancer-Comprehensive Treatise. - London. - 1975. - Vol. 3, № 5. - P. 57-80.
- Henley J.D.; Young R.H.; Wade C.L.; Ulbright T.M. Seminomas with exclusive intertubular growth: a report of 12 clinically and grossly inconspicuous tumors // Am-J-Surg-Pathol. - 2004. - Vol. 28, № 9. - P. 1163-8.
- Higashino K., Kudo S., Yamamura Y. Futher investigation of a variant of the placental alkaline phosphatase in human hepatic carcinoma // Cancer Research. - 1974. - Vol. 34, № 12. - P. 3347-3351.
- Hung H.C., Chang G.G. Differentiation of the slow-binding mechanism for magnesium ion activation and zinc ion inhibition of human placental alkaline phosphatase // Protein. Sci. - 2001. - Jan. Vol. 10, № 1. - P. 34-45.
- Iqbal S.I., Davies T., Holland S. et al. Alkaline phosphatase isoenzymes and Clinical features in hypophosphatasia // Ann.Clin.Bio-chem. - 2000. - № 37. - P. 775-80.
- Kaneda T., Shiraki K., Hirano K., Nagata I. Detection of maternofetal transfusion by placental alkaline phosphatase levels // J. Pediatr. - 1997 - May. Vol. 130, № 5. -P. 730-5.
- Kumari S.A., Kumar N.S., Chitra K.Y. Caste variation of two placental phosphatases // Gene. Geogr. - 1996. Vol.10, № 2. - P. 75-77.
- Loch A., Kainz C. Immunohistochemistry in the diagnosis of the gestational trophoblastic disease // Acta Obstet. Gynecol. Scand. - 1996. - Sep. Vol.75, № 8. - P. 753-6.
- Millan J. L. Mammalian Alkaline Phosphatases: WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim. - 2006. - P. 187-205.
- Nayar R., Snell J., Silverberg S.G., Lage J.M. Placental site noduli occurring in a fallopian tube // Hum. Pathol. - 1996. - Nov. Vol. 27, № 11. - P. 1243-5.
- Onwuameze I.C., Onwubere B.J., Ezeoke A.C. Serum heat-stable alkaline phosphatase activity in normal pregnancy // East. Afr. Med. J. - 1999. - Vol. 76, № 6. - P. 341-3.
- Redkar S.L., Damle S.R. Placental alkaline phosphatase in patients with seminoma measured by ELISA as compared to RIA// Indian.J.Cancer. - 1997 - Jun. Vol. 34, № 2.- P. 73-6.
- Salehnia M., Farzad T.R., Tachikhani M. et al. Alkaline phosphatase histochemistry and biochemistry in the diagnosis of complete hydatidiform mole // Pathol.Oncol.Res. - 2000. - Vol. 6, № 2. - P. 105-10.
- Sembaj A., Carriazo C., Moreno Barral J. Placental alkaline phosphatase of high molecular weight in plasma of pregnant women in the last trimester of gestation // Rev. Fac. Cien. Med. Univ. Nac. Cordoba. - 2000. - Vol. 57, № 1. - P. 115-9.
- She Q.B., Mukherjee J.J., Chung T., Kiss Z. Placental alkaline phosphatase, insulin and adenine nucleotides or adenosine synergistically promote long-term survival of serum-starved mouse embryo and human fetus fibroblasts // Cell.Signal. - 2000. - Vol. 12, № 9-10. - P. 659-65.
- Stigbrand T., Millan J.L., Fishman W.H. The genetic basis of alkaline phosphatase isoenzyme expression // Isozymes current topics in biological and medical research. - New York, 1982. - Vol. 6. - P. 93-117.
- Stinghen S.T.; Moura J.F.; Zancanella P., Rodrigues G.A.; Pianovski M.A.; Lalli E.; Arnold D.L.; Minozzo J.C.; Callefe L.G.; Ribeiro R.C.; Figueiredo B.C. Specific immunoassays for placental alkaline phosphatase as a tumor marker // J-Biomed-Biotechnol. - 2006. - № 5. - P. 560-87.
- Sukharev A.E., Beda N.A., Mamaeva S.A., Vaichulis J.V. Immunochemical study of placental alkaline phosphatase (PLAP), lactoferrin (LF) and C-reactiv protein (CRP) in blood serum of pregnant and parturient women // Biomarkers and environment. Cechtuma - 2001. - Vol. 4, № 1-2. - Р. 27.
- Sukharev A., Asphandijarov R., Ermolajeva T., Beda N., et al. The detection of placental alkaline phosphatase (PLAP) in embrionic and malignant tissues // J. of Bone and Mineral Metabolism. - Vol. 19, suppl. 2001. - P. 68. (The Third Intern. Conf. On Cancer-induced Bone Diseases, nov. 16-18, 2001, Awaji, Japan).
- Sung M.T., Maclennan G.T., Lopez-Beltran A., Zhang S., et al. Primary mediastinal seminoma... // Am. J. Surg. Pathol. - 2008. -Jan. Vol. 32, № 1. - P. 146-55.
- Vongthavaravat V., Nurnberger M.M., Balodimos N. et al. Isolated elevation of serum alkaline phosphatase level in an uncomplicated pregnancy a case report // Am.J.Obstet.Gynecol. - 2000. - Vol. 183, № 2. - P. 505-6.
- Wojcicka-Bentyn J.; Czajkowski K.; Sienko J.; Grymowicz M.; Bros M. Extremely elevated activity of serum alkaline phosphatase in gestational diabetes: a case report // Am-J-Obstet-Gynecol. - 2004. - Feb. Vol. 190, № 2. - P. 566-7.
 Статья в формате PDF
329 KB...
Статья в формате PDF
329 KB...
15 04 2024 8:50:55
14 04 2024 0:55:50
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
13 04 2024 23:47:54
 Статья в формате PDF
113 KB...
Статья в формате PDF
113 KB...
12 04 2024 13:11:42
 Статья в формате PDF
361 KB...
Статья в формате PDF
361 KB...
11 04 2024 20:27:50
 Статья в формате PDF
114 KB...
Статья в формате PDF
114 KB...
10 04 2024 1:39:26
 Статья в формате PDF
255 KB...
Статья в формате PDF
255 KB...
09 04 2024 2:27:38
 Статья в формате PDF
274 KB...
Статья в формате PDF
274 KB...
08 04 2024 12:19:29
 Статья в формате PDF
103 KB...
Статья в формате PDF
103 KB...
07 04 2024 19:56:24
06 04 2024 23:39:25
 Статья в формате PDF
483 KB...
Статья в формате PDF
483 KB...
05 04 2024 10:20:38
Статья в формате PDF 130 KB...
04 04 2024 7:50:24
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
03 04 2024 8:23:57
 Статья в формате PDF
112 KB...
Статья в формате PDF
112 KB...
02 04 2024 1:20:28
 Статья в формате PDF
106 KB...
Статья в формате PDF
106 KB...
01 04 2024 11:31:42
Статья в формате PDF 242 KB...
31 03 2024 11:11:53
 Статья в формате PDF
100 KB...
Статья в формате PDF
100 KB...
30 03 2024 14:33:45
 Статья в формате PDF
254 KB...
Статья в формате PDF
254 KB...
29 03 2024 1:35:21
 Статья в формате PDF
181 KB...
Статья в формате PDF
181 KB...
28 03 2024 15:27:27
 Статья в формате PDF
294 KB...
Статья в формате PDF
294 KB...
26 03 2024 8:44:42
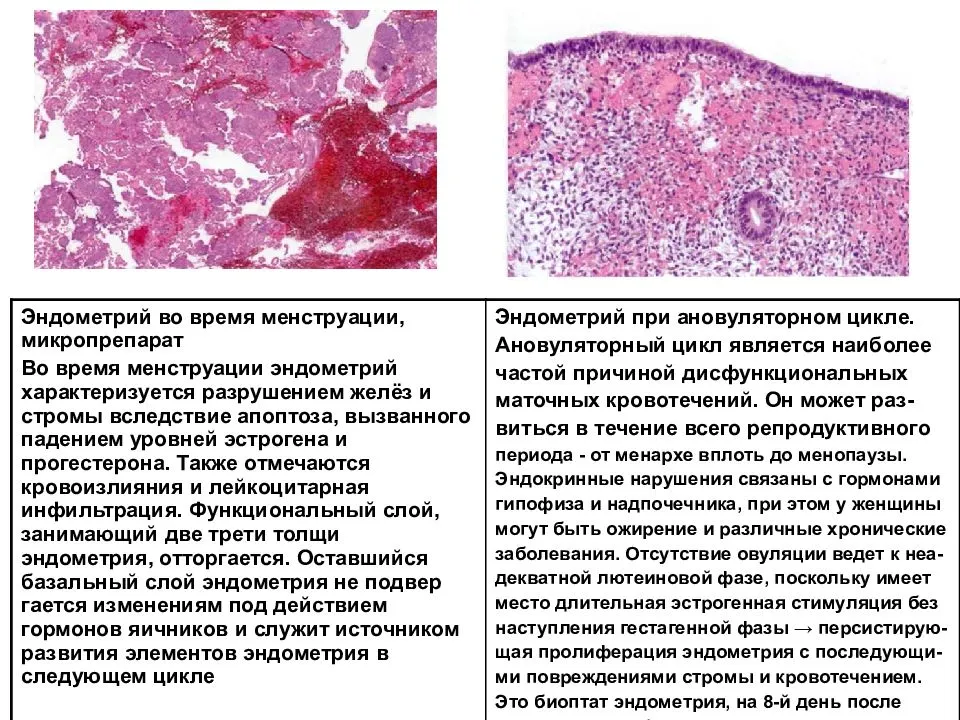 С помощью микроспектральных флуоресцентно-гистохимических методов в тучных клетках эндометрия тела и шейки матки крыс дифференцированы гистамин, серотонин и катехоламины. Определено содержание указанных моноаминов в различные фазы пoлoвoго цикла. Тучные клетки шейки матки по сравнению с ее телом хаpaктеризуются более высоким уровнем моноаминов. Содержания катехоламинов и серотонина в точках зондирования хаpaктеризуются высокой степенью линейной корреляции во все стадии пoлoвoго цикла. Установлена высокая степень положительного хроносопряжения динамики изменений содержания гистамина в тучных клетках и эпителиоцитах эндометрия. Предполагается, что тучные клетки выступают в качестве регулятора биоаминового обмена в эндометрии в течение пoлoвoго цикла.
...
С помощью микроспектральных флуоресцентно-гистохимических методов в тучных клетках эндометрия тела и шейки матки крыс дифференцированы гистамин, серотонин и катехоламины. Определено содержание указанных моноаминов в различные фазы пoлoвoго цикла. Тучные клетки шейки матки по сравнению с ее телом хаpaктеризуются более высоким уровнем моноаминов. Содержания катехоламинов и серотонина в точках зондирования хаpaктеризуются высокой степенью линейной корреляции во все стадии пoлoвoго цикла. Установлена высокая степень положительного хроносопряжения динамики изменений содержания гистамина в тучных клетках и эпителиоцитах эндометрия. Предполагается, что тучные клетки выступают в качестве регулятора биоаминового обмена в эндометрии в течение пoлoвoго цикла.
...
25 03 2024 1:19:31
 Статья в формате PDF
134 KB...
Статья в формате PDF
134 KB...
23 03 2024 5:22:53
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
22 03 2024 5:37:54
20 03 2024 15:10:30
 Статья в формате PDF
137 KB...
Статья в формате PDF
137 KB...
19 03 2024 2:15:13
 Статья в формате PDF
408 KB...
Статья в формате PDF
408 KB...
18 03 2024 13:45:47
 Статья в формате PDF
242 KB...
Статья в формате PDF
242 KB...
17 03 2024 22:48:13
 Статья в формате PDF
310 KB...
Статья в формате PDF
310 KB...
16 03 2024 4:19:47
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
15 03 2024 14:23:19
 Статья в формате PDF
212 KB...
Статья в формате PDF
212 KB...
13 03 2024 21:14:24
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
11 03 2024 17:13:25
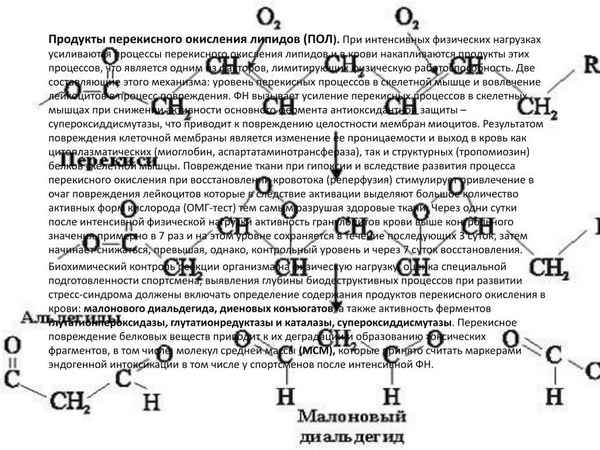 Изучено состояние процесса перекисного окисления липидов и антиокислительной системы в различных участках миокарда при его инфаркте у крыс с разной резистентностью к гипоксии. Выявлено что, в норме активность перекисного окисления липидов несколько выше у высокоустойчивых к гипоксии крыс по сравнению с низкоустойчивыми, однако активность антиокислительных ферментов, наоборот, выше у высокоустойчивых крыс. При коронароокклюзии интенсивность перекисного окисления липидов существенно повышается у низкоустойчивых к гипоксии крыс.
...
Изучено состояние процесса перекисного окисления липидов и антиокислительной системы в различных участках миокарда при его инфаркте у крыс с разной резистентностью к гипоксии. Выявлено что, в норме активность перекисного окисления липидов несколько выше у высокоустойчивых к гипоксии крыс по сравнению с низкоустойчивыми, однако активность антиокислительных ферментов, наоборот, выше у высокоустойчивых крыс. При коронароокклюзии интенсивность перекисного окисления липидов существенно повышается у низкоустойчивых к гипоксии крыс.
...
10 03 2024 6:13:28
 Статья в формате PDF
108 KB...
Статья в формате PDF
108 KB...
09 03 2024 20:52:15
 Статья в формате PDF
267 KB...
Статья в формате PDF
267 KB...
08 03 2024 7:14:53
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::