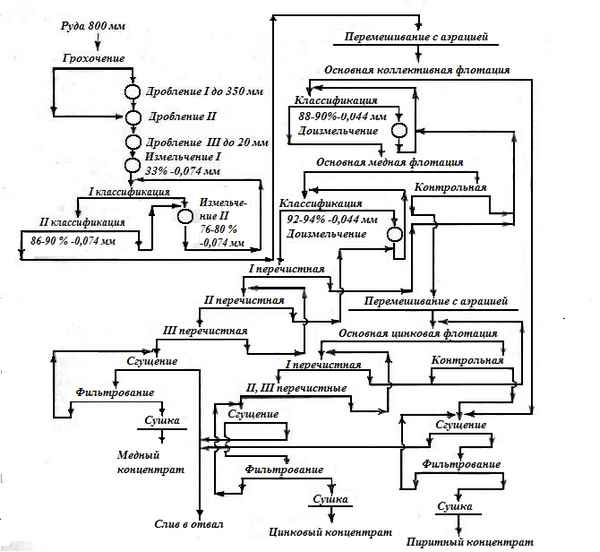
РАЗРАБОТКА ИНДИКАТОРНОЙ СРЕДЫ ДЛЯ СЕЛЕКТИВНОГО ВЫДЕЛЕНИЯ МИКРООРГАНИЗМОВ РОДА LISTERIA ИЗ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ (ИСС-1)

Наибольшую опасность листериозная инфекция, возбудителем которой является L.monocytogenes, представляет для беременных женщин и новорожденных, вызывая выкидыши, мертворождения, пороки развития плода, а также менингоэнцефалиты, сепсис и пневмонии у новорожденных. Несмотря на своевременную антибиотикотерапию, cмepтность при перинатальном и неонатальном листериозе достигает 30-50%, в том числе при внутрибольничных вспышках в роддомах [Тартаковский И.С.,2002; Омарова С.М.,2007].
Увеличение случаев листериоза среди беременных женщин и новорожденных диктует настоятельную необходимость создания эффективных методов и схем диагностики листериоза с применением селективных питательных сред.
Зарубежные фирмы - производители питательных сред [«Oxoid», «BBL», «Merck», «bio Merieux», «Himedia» и др.] выпускают коммерческие селективные среды для накопления, выделения, и идентификации листерий. Однако использование этих сред в пpaктических лабораториях нашей страны крайне ограничено в связи с их высокой стоимостью.
Согласно принятым в РФ в 2002г. нормативным документам [МУК 4.2.1122-02] для изоляции и первичной идентификации листерий предлагают использовать в основном зарубежные селективные среды, среди которых рекомендован лишь один отечественный препарат ПАЛ. В настоящее время разработаны и имеют производственный выпуск ряд отечественных питательных сред для культивирования, выделения и идентификации листерий. Кроме того, разработаны микротестсистемы для биохимической идентификации листерий - МТС-5Л и МТС-12Л [Омарова С.М. с соавт.,2007]. Однако полиморфизм и непостоянство биологических свойств листерий диктует необходимость разработки новых отечественных селективных питательных сред для диагностики листериоза, с целью пополнения арсенала бактериологических лабораторий средами целевого назначения.
Как известно, питательные среды для микробиологического исследования должны обеспечивать благоприятные условия для выделения клинически значимых возбудителей инфекционных заболеваний. При выращивании микроорганизмов условия, в которых происходит рост, все время меняются: увеличивается плотность популяции, уменьшается концентрация субстрата и других ростовых факторов, происходит сдвиг рН среды, что приводит к задержке роста микроорганизмов.
Первым этапом выбора оптимального компонентного состава среды является качественный отбор необходимых для данной бактерии химических элементов, с учетом ростовых потребностей культуры, в частности листерий. В основу оптимизируемого состава среды может быть положен ранее известный для этого микроорганизма состав среды, к которому должны быть добавлены вещества, оказывающие положительный эффект на рост микроорганизма. Исходя из этого, в работе использовали известную рецептуру среды ПАЛКАМ с дальнейшей ее модификацией и оптимизацией компонентного состава препарата.
В процессе разработки индикаторной селективной среды (ИСС-1Л) проводилась качественная и количественная оценка влияния отобранных компонентов на ростовые свойства изучаемой культуры.
Особенно часто бактерии испытывают недостаток в отдельных витаминах, которые используются ими при синтезе различных ферментов, участвующих в свою очередь, в синтезе необходимых для микробной клетки веществ. Известно, что потребность микроорганизмов в витаминах группы «В» в питательных средах промышленного изготовления удовлетворяется в основном за счет экстpaкта кормовых дрожжей - ЭКД [Меджидов М.М., Султанов З.З., 2003].
Сопоставляя данные литературы с результатами предыдущих исследований, в качестве стимуляторов роста и размножения листерий использовали глюкозу, витаминный препарат «ЭКД», а также вещество, которое ранее не использовалось в рецептурах сред для культивирования листерий - парааминобензойную кислоту (ПАБК). ПАБК участвует в биосинтезе витамина В9 - фолиевой кислоты, функции которой в метаболизме бактерий связаны с синтезом аминокислот, пуриновых и пиримидиновых оснований. Вещество также является наиболее специфичным и весьма активным антагонистом сульфаниламидов, вследствие чего добавление ее в питательную среду обезвреживает токсичность лекарственных препаратов, и как следствие, стимулирует рост бактерий (Гостев В.С., 1951г., Герхард Ф., 1983г.).
По нашим наблюдениям сочетанное применение стимуляторов роста - экстpaкта кормовых дрожжей и ПАБК приводило к увеличению чувствительности среды до 10-7 и размера выросших колоний. Добавление в состав среды глюкозы в сочетании с основой из рыбного панкреатического гидролизата, обеспечивает усвоение углерода, взамен мышечного сахара, который содержится в мясной воде.
Трудности при выявлении и выделении листерий из клинического материала, как известно связанны с содержание контаминантов в исследуемых образцах. Особенно важную роль при этом играет энтерококк, который препятствует идентификации листерий, так как приобретает цвет среды и колоний схожий с листериями. Поэтому, для подавления роста ассоциантов в базовый состав среды в качестве селективных агентов ввели налидиксовую кислоту и акрифлавина гидрохлорид, а также хлорид лития с цитратом железа аммонийного.
Исследование ингибирующих свойств экспериментальных серий среды ИСС-1 для, проводили в модельных опытах высевом смесей чистых культур листерий и микробов-ассоциантов (P. vulgaris , E. coli, S. aureus
и Е. faecalis). Выявлено преимущество испытуемой среды перед контрольной: рост посторонней микрофлоры на испытуемой среде полностью подавлялся. Сочетанное использование этих компонентов в оттитрованных концентрациях позволяет с высокой степенью надежности дифференцировать L. monocytogenes от посторонней микрофлоры.
Кроме ростовых факторов и ингибиторов сопутствующей микрофлоры данная среда, как и зарубежный аналог, содержит индикатор-краситель феноловый красный и маннит, позволяющие выявлять и идентифицировать колонии Listeria spp. за исключением L.grayi, которые не вызывают заболеваний у людей. Листерии не способны гидролизовать маннит вследствие чего не происходит окисления среды, и ореол вокруг темно-серых колоний остается темно-коричневого цвета. Готовая среда с индикаторами роста листерий имеет красный цвет с хаpaктерным перламутровым отливом на фоне, которого отчетливо отмечается хаpaктерный рост листерий. Энтерококки в отличие от патогенных листерий в состоянии метаболизировать маннит. В результате этого метаболизма происходит окисление среды, что приводит к смене индикатором цвета ореола вокруг колоний в желтый.
Согласно методическим рекомендациям ФГУН ГИСК им. Л.А. Тарасевича одним из основных оценочных показателей качества разpaбатываемых питательных сред является сохранение стабильности биологических свойств культур, выращенных на этих питательных средах. Разработанная нами индикаторная среда не уступает контрольной по основным показателям: обладает высокой чувствительностью (10-7) и скоростью роста (18±2ч). За время инкубации на среде вырастают серого цвета колонии с коричнево-черным ореолом (d=1,7±0,2мм). Эффективность среды ИСС-1 составляет в среднем (1,9±0,1)х109 м.к./мл. При определении морфологии листерий в мазках отмечали типичные хаpaктерные мелкие грамположительные палочки. Жизнеспособность выращенных на индикаторной среде культур листерий составила 78,2±1,2%.
 Статья в формате PDF
116 KB...
Статья в формате PDF
116 KB...
09 03 2026 8:15:58
 Статья в формате PDF
119 KB...
Статья в формате PDF
119 KB...
08 03 2026 3:46:20
 Статья в формате PDF
102 KB...
Статья в формате PDF
102 KB...
07 03 2026 20:33:57
06 03 2026 15:12:48
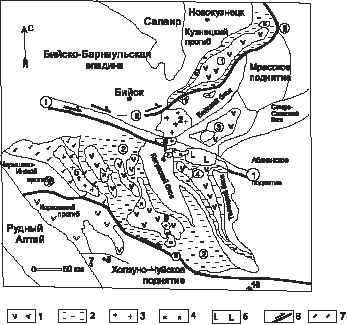 Приведены геологические, геохимические и петрологические данные по щелочным гранитоидам майорского комплекса среднего девона. В его составе описаны 4 фазы внедрения: 1) роговообманковые габбро, габбро-нориты и габбро-диориты; 2) кварцевые диориты, гранодиориты амфибол-биотитовые; 3) биотит-амфиболовые граниты, субщелочные и рибекитовые граниты; 4) субщелочные лейкограниты, лейкограниты. Петрогеохимическими особенностями гранитоидов майорского типа являются повышенная щёлочность и наличие щелочного амфибола – рибекита. Прострaнcтвенно и парагенетически с майорскими гранитами, относящимися к анорогенной геодинамической обстановке формирования, ассоциирует железорудное и редкоземельное оруденение и щелочные метасоматиты. В экзоконтакте с Майорским массивом сформировались везувиан-гранат-пироксеновые скарны.
...
Приведены геологические, геохимические и петрологические данные по щелочным гранитоидам майорского комплекса среднего девона. В его составе описаны 4 фазы внедрения: 1) роговообманковые габбро, габбро-нориты и габбро-диориты; 2) кварцевые диориты, гранодиориты амфибол-биотитовые; 3) биотит-амфиболовые граниты, субщелочные и рибекитовые граниты; 4) субщелочные лейкограниты, лейкограниты. Петрогеохимическими особенностями гранитоидов майорского типа являются повышенная щёлочность и наличие щелочного амфибола – рибекита. Прострaнcтвенно и парагенетически с майорскими гранитами, относящимися к анорогенной геодинамической обстановке формирования, ассоциирует железорудное и редкоземельное оруденение и щелочные метасоматиты. В экзоконтакте с Майорским массивом сформировались везувиан-гранат-пироксеновые скарны.
...
05 03 2026 13:15:21
 Статья в формате PDF
304 KB...
Статья в формате PDF
304 KB...
04 03 2026 23:55:46
 Статья в формате PDF
113 KB...
Статья в формате PDF
113 KB...
03 03 2026 18:48:27
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
02 03 2026 20:27:39
 Статья в формате PDF
124 KB...
Статья в формате PDF
124 KB...
01 03 2026 11:23:22
 Статья в формате PDF
264 KB...
Статья в формате PDF
264 KB...
28 02 2026 22:58:26
Статья в формате PDF 234 KB...
27 02 2026 5:23:51
 Статья в формате PDF
309 KB...
Статья в формате PDF
309 KB...
26 02 2026 15:58:36
 Статья в формате PDF
225 KB...
Статья в формате PDF
225 KB...
25 02 2026 15:52:43
24 02 2026 13:38:28
 Статья в формате PDF
126 KB...
Статья в формате PDF
126 KB...
23 02 2026 21:16:27
 Статья в формате PDF
127 KB...
Статья в формате PDF
127 KB...
22 02 2026 19:35:36
 Статья в формате PDF
129 KB...
Статья в формате PDF
129 KB...
21 02 2026 1:21:25
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
20 02 2026 11:11:49
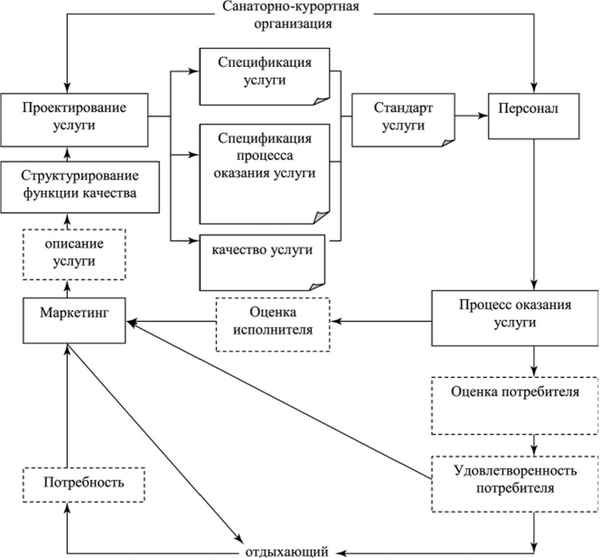 Статья в формате PDF
134 KB...
Статья в формате PDF
134 KB...
19 02 2026 18:54:33
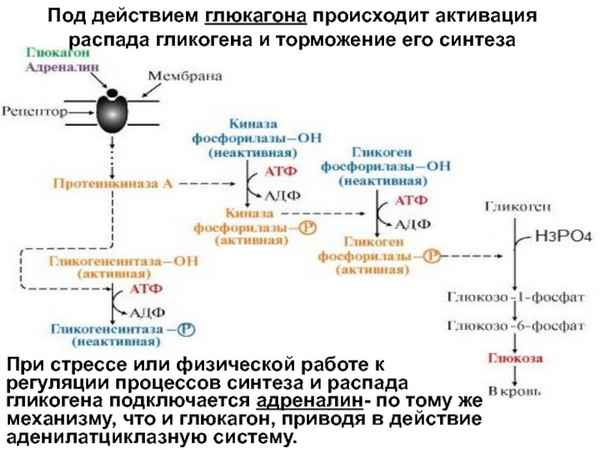 В работе исследовали влияние этацизина и димефосфона на cмepтность белых мышей и динамику поведенческих реакций в условиях хронического гиподинамического стресса. Показано токсическое влияние этацизина: увеличение cмepтности животных и негативное влияние на поведенческие реакции. Димефосфон не оказывал влияния на летальность и проявлял стресспротекторное
...
В работе исследовали влияние этацизина и димефосфона на cмepтность белых мышей и динамику поведенческих реакций в условиях хронического гиподинамического стресса. Показано токсическое влияние этацизина: увеличение cмepтности животных и негативное влияние на поведенческие реакции. Димефосфон не оказывал влияния на летальность и проявлял стресспротекторное
...
18 02 2026 19:28:45
 Статья в формате PDF
261 KB...
Статья в формате PDF
261 KB...
15 02 2026 16:40:43
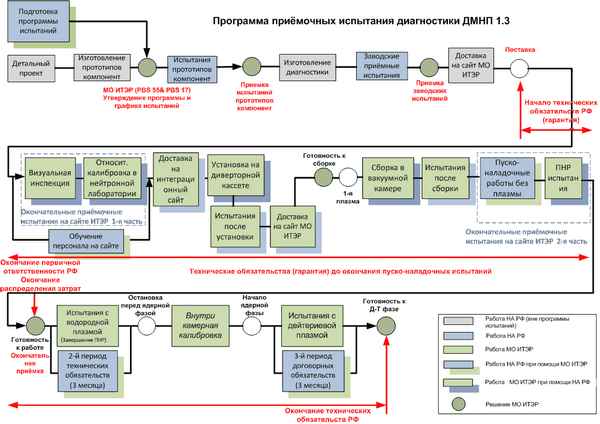 Разработан пакет графических алгоритмических моделей отбpaковочных испытаний радиоприемных устройств, изготавливаемых и выпускаемых предприятием, как первый шаг к последующей автоматизации. Показано преимущество разработанных моделей по сравнению с действующей текстовой инструкцией по проведению испытаний.
...
Разработан пакет графических алгоритмических моделей отбpaковочных испытаний радиоприемных устройств, изготавливаемых и выпускаемых предприятием, как первый шаг к последующей автоматизации. Показано преимущество разработанных моделей по сравнению с действующей текстовой инструкцией по проведению испытаний.
...
14 02 2026 17:21:11
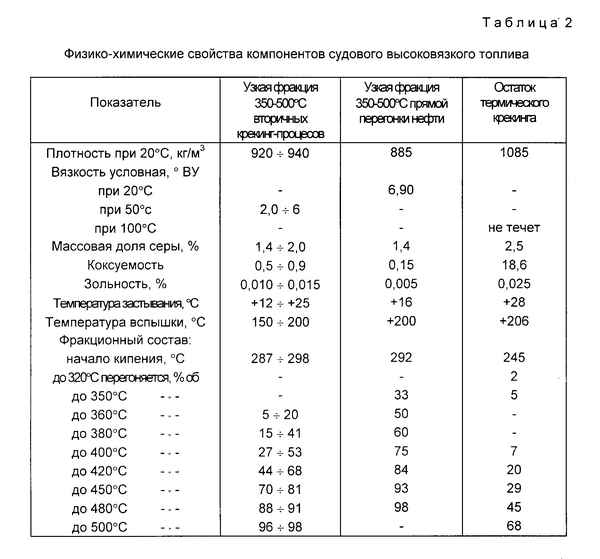 Статья в формате PDF
254 KB...
Статья в формате PDF
254 KB...
11 02 2026 1:31:47
 Статья в формате PDF
109 KB...
Статья в формате PDF
109 KB...
10 02 2026 0:34:48
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
09 02 2026 10:19:39
06 02 2026 0:37:27
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
05 02 2026 2:19:42
 Статья в формате PDF
104 KB...
Статья в формате PDF
104 KB...
03 02 2026 18:51:49
 Статья в формате PDF
233 KB...
Статья в формате PDF
233 KB...
01 02 2026 12:15:36
 Статья в формате PDF
182 KB...
Статья в формате PDF
182 KB...
30 01 2026 20:44:42
 Статья в формате PDF
139 KB...
Статья в формате PDF
139 KB...
29 01 2026 20:55:20
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::