АЛЬФА-ФЕТОПРОТЕИН – НОВЫЕ ПОДХОДЫ К ИЗУЧЕНИЮ СТРУКТУРЫ И ФУНКЦИИ

Альфа-фетопротеин принадлежит к семейству белков альбуминоидных генов, наряду с сывороточным альбумином, витамин Д-связывающим белком и, обнаруженным относительно недавно, альфа - альбумином (афамина). По химической структуре АФП является гликопротеином, содержащим до 3-5 % углеводов. Молекулярная масса этого белка колeблется в пределах 68-73 кДа, в зависимости от содержания углеводов и вида животного, из которого он был выделен. Первичная структура АФП установлена на основе анализа нуклеотидной последовательности его м-РНК, продукт трaнcляции которой у человека содержит 609 аминокислотных остатков (SwissProt P02771). В ходе процессинга отщепляется 18 аминокислотных остатков и в состав зрелой молекулы АФП человека входит 591 аминокислота. В составе АФП человека был также обнаружен один участок гликозилирования и 15 равномерно расположенных дисульфидных связей. Представители семейства белков альбуминоидных генов демонстрируют относительно высокую степень сходства первичной структуры (например, 39% идентичности наблюдается между аминокислотными последовательностями альфа - фетопротеина и сывороточного альбумина) с хаpaктерным расположением остатков цистеина. Они имеют также сходную α-спиральную вторичную структуру (так, до 65-67% α-спиральных участков хаpaктерно для АФП и около 50 % - для альбумина). Методом электронной микроскопии продемонстрировано существование U-образной структуры АФП с тремя областями плотности масс: одна на вершине и две по краям молекулы. На основании этих данных предложена трехдоменная прострaнcтвенная организация его молекулы. Показано, что домены I и III имеют жесткую, компактно упакованную третичную структуру и связаны между собой протеолитически лабильным, гибким доменом II, конформация которого соответствует форме расплавленной глобулы (MGF-molten globule form). С-концевая часть домена II представляет собой гибкий шарнирный участок, который придает всем доменам подвижность и, тем самым, способствует взаимодействию АФП с лигандами или с другими белками. Несмотря на стабильность в растворе, АФП обладает достаточной конформационной подвижностью и изменяет конформацию под воздействием различных факторов, таких как высокие концентрации эстрогенов и жирных кислот, изменение рН среды и др. Изменение конформации молекулы сопровождается изменением антигенных и функциональных свойств АФП. Предполагается, что в нативной молекуле АФП часть биологически активных участков скрыты внутри белковой глобулы, которые выявляются, становясь доступными для взаимодействия, лишь при изменениях конформации молекулы.
До настоящего времени в связи трудностями, возникающими при кристаллизации альфа - фетопротеина, получение его трехмерной структуры (3D) с помощью экспериментальных методов (рентгеноструктурного анализа и ЯМР спектроскопии) представляет собой трудно разрешимую задачу. Наличие достаточно высокой степени сходства (39% идентичности) между аминокислотными последовательностями АФП и сывороточного альбумина, для которого трехмерная (3D) структура установлена с помощью рентгеноструктурного анализа, предоставляет возможность для компьютерного построения модели прострaнcтвенной структуры АФП с помощью метода молекулярного моделирования на основе гомологии с альбумином. АФП и альбумин имеют общее происхождение и являются гомологичными белками. Для моделирования на основе гомологии важным является то обстоятельство, что трехмерная структура (способ укладки) гомологичных белков является в большей степени консервативной, чем их первичная структура.
Нами была предпринята попытка построения модели трехмерной организации молекулы АФП человека на основании гомологии с сывороточным альбумином, оптимизации полученной структуры с привлечением экспериментальных данных, оценки структуры и её анализа, включая расположение биологически активных участков. В международной базе данных PDB (protein data bank), содержащей все известные 3D структуры белков, было обнаружено 24 трехмерные структуры сывороточного альбумина человека. Из них для построения модели были отобраны шесть 3D структур (1AO6, 1BM0, 1E7A, 1GNI, 1HA2, 1UOR) которые были получены с высокой степенью разрешения (менее 3.0А) и отличались наличием или отсутствием в своем составе лиганда. Одна из них (1UOR) представляла собой кристаллическую структуру рекомбинантного сывороточного альбумина человека. Выравнивание аминокислотных последовательностей АФП и альбумина осуществляли с помощью компьютерной программы ClustalW. Для построения модели применяли программу MODELLER и использовали в качестве шаблона структуру 1GNI. Было построено пять моделей 3D структур АФП человека, из которых одна, с наименьшим objective function была отобрана для минимизации энергии. Расчет элементов вторичной структуры в полученной модели производили с использованием метода Кабаша-Сендера.
В настоящее время в составе альфа-фетопротеина разными группами авторов выявлен целый ряд участков с подтвержденной или предполагаемой биологической активностью. Одним из участков с изученной биологической активностью является гептапептид LDSYQCT в составе АФП человека (а.о. 14-20), обладающий иммуномодулирующими свойствами. Другим таким участком является пептид, ингибирующий рост (GIP - growth inhibitory peptide), включающий аминокислотные остатки 446-479, ответственный за способность АФП подавлять эстроген-зависимую пролиферацию клеток матки непoлoвoзрелых самок мышей и рост эстроген-зависимых опухолей [Mizejewski G.J., MacColl R., 2003]. Срединный гидрофобный фрагмент пептида GIР, представляющий собой аминокислотную последовательность AADIIIGHLCIRHE (а.о.458-471), оказался способным связывать свободный 17-β-эстрадиол. Нами было выявлено, что в трехмерной структуре АФП гептапептид LDSYQCT располагается близко к поверхности молекулы, в то время как пептид GIР расположен внутри молекулы и занимает самый протяженный альфа-спиральный участок АФП человека.
Использование методов биоинформатики является ещё одним перспективным подходом для исследования АФП. С использованием программы ClustalW (версия 1.82) и баз данных первичных структур белков Swiss-Prot и TrEMBL нами проведено попарное и множественное выравнивание последовательностей белков семейства альбуминоидных генов, к которому, наряду с СА, афамином и витамин Д-связывающим белком, принадлежит АФП. На основе полученных данных осуществлен анализ филогенетических взаимоотношений этих белков и консервативных аминокислотных остатков в функционально активных участках, что может оказаться важным для понимания взаимосвязи структуры и функции не только АФП, но и других белковых молекул.
В составе АФП выявлен ряд участков с подтвержденной или предполагаемой биологической активностью: участки связывания эстрогенов, жирных кислот и билирубина, пептид, ингибирующий рост (GIP), мотивы гетеро- и гомодимеризации и др. Выявленный нами методами биоинформатики в составе АФП человека гептапептид LDSYQCT (АФП14-20) обладает иммуномодулирующими свойствами. Нами изучаются конформационно-динамические свойства данного пептида и его аналогов, методами молекулярной динамики (МД), а также сконструирована модельная система и изучается взаимодействие эстрогенсвязывающих пептидов АФП с 17β-эстрадиолом. Метод МД основан на расчете классических (ньютоновских) траекторий движения молекулы в фазовом прострaнcтве координат и импульсов ее атомов, и позволяет провести детальный (микроскопический) анализ конформационно-динамических процессов, происходящих в макромолекуле. Результаты анализа (данные о структуре и межмолекулярных взаимодействиях) можно сравнивать с экспериментально измеряемыми величинами, а также получать информацию о параметрах, которые трудно определить экспериментальными способами. Метод МД обеспечивает новым подходом к пониманию архитектуры и динамических свойств АФП и его пептидов, а также механизма их функционирования.
Обнаружение в составе альфа-фетопротеина (АФП) множества функционально важных участков позволяет сделать предположение о том, что альфа-фетопротеин является резервуаром биологически активных пептидов, которыми он обеспечивает растущие эмбриональные ткани. В этом может заключаться основное биологическое значение АФП в эмбриогенезе. Биологически активные пептиды АФП могут участвовать в регуляции различных физиологических процессов, в том числе: пролиферации клеток и роста тканей, пoлoвoй дифференцировки и развития репродуктивных органов плода, развития и функционирования иммунной системы, трaнcпорта гидрофобных лигандов (например, эстрогенов, необходимых для развития мозга) и др.
В течение последних десяти лет методами биоинформатики - путем сравнения первичных структур альфа-фетопротеина и ряда других белков в составе АФП выявлено более двадцати функционально важных участков. Часть пептидных фрагментов АФП человека получена синтетическим путем, и биологическая активность для них подтверждена экспериментально. Биологическая активность другой части пептидов лишь предсказана и требует эскпериментального подтверждения. Проведено картирование первичной структуры альфа-фетопротеина с указанием аминокислотных последовательностей и места в первичной структуре АФП, выявленных биологически активных участков [Терентьев А.А., Молдогазиева Н.Т., 2006].
Одним из пептидов с относительно изученной биологической активностью является гептапептид LDSYQCT (а.о. 14-20), выявленный в составе АФП человека методом сравнения аминокислотных последовательностей альфа-фетопротеина и ряда факторов роста, а также некоторых онкофетальных белков. Вышеназванный участок оказался сходен с последовательностью LDKYTC в составе ЭФР человека (а.о. 26-31), а также с последовательностью ENYCN (а.о. 17-21) в составе α-цепи инсулина. Пептидные фрагменты АФП и инсулина были получены синтетическим путем и изучены в различных тестах биологической активности. Гептапептид альфа-фетопротеина в концентрации 10-5 М достоверно повышал утилизацию глюкозы эритроцитами больных инсулинозависимым и инсулинонезависимым сахарным диабетом. Пептид LDSYQCT обладает также иммуномодулирующими свойствами. В реакции бласттрaнcформации в концентрациях 10-7, 10-8 и 10-9 М гептапептид умеренно стимулировал пролиферацию неактивированных лимфоцитов и проявлял выраженное ингибирующее действие на пролиферацию лимфоцитов, активированных ФГА. Он дозозависимо стимулировал спонтанную пролиферацию лимфоцитов с максимальным эффектом (в 2,2 раза) при концентрации 10 мкг/мл. В культуре клеток К-562 гептапептид повышал в 1,5-2 раза цитотоксическую активность естественных киллеров (ЕК). Выяснилось также, что он обладает дозозависимым ингибирующим эффектом на пролиферативную активность лимфоцитов больных острым лимфолейкозом, а также спонтанную пролиферацию лимфоцитов больных хроническим лимфолейкозом с низкой чувствительностью к цитозару, т.е. пептид усиливает антипролиферативную активность этого препарата. В культуре клеток больных инфекционно-аллергическим миокардитом с естественно активированными лимфоцитами гептапептид достоверно понижает экспрессию позднего активационного антигена HLA-DR и индуцирует экспрессию рецептора Fas-опосредованного апоптоза (CD95). Увеличение количества CD95+ лимфоцитов свидетельствует в пользу предположения о том, что гептапептид LDSYQCT индуцирует апоптоз, так как этот процесс зависит от Fas/FasL клеточного взаимодействия.
О значительной роли альфа-фетопротеина в торможении канцерогенеза свидетельствует его способность индуцировать апоптоз и ингибировать рост эстроген-зависимых опухолей. Это подтверждается также обнаружением в его первичной структуре пептида, ингибирующего рост (GIP- growth inhibitory peptide), включающего аминокислотные остатки 446-479 и ответственного за способность АФП подавлять эстроген-зависимую пролиферацию клеток матки непoлoвoзрелых самок мышей и рост эстроген-зависимых опухолей [Mizejewski G.J., MacColl R., 2003]. Было показано, что фрагмент пептида GIP, представляющий собой октапептид EMTPVNPG (а.о. 471-478), обладает максимальной биологической активностью. Его эффективность в тесте ингибирования эстрогензависимой пролиферации клеток матки у мышей составляет 49%, в то время как этот показатель для целого пептида Р447 равен 45%, а для интактного АФП - 35%. Также, в модели in vivo было показано, что этот пептид, как и интактная молекула АФП, снижает фетотоксичность эстрогенов и инсулина. Под воздействием альфа-фетопротеина и пептида GIP дефекты развития плода уменьшаются на 50%, а гибель плода во время внутриутробного развития - на 63-73%.
В составе альфа-фетопротеина обнаружены также аминокислотные последовательности, сходные с участками ряда цитокинов и белков индукции апоптоза (рецептора фактора некроза опухолей TNFRα, белка Bcl-2 и др.). Обнаружены также участки антигенов главного комплекса гистосоместимости II класса, белков экстрацеллюлярного матрикса, мотивы гомо- и гетеродимеризации, хаpaктерные для ядерных стероидных и тиреоидных рецепторов. Локализован также основной участок связывания полиненасыщенных жирных кислот, участки связывания эстрогенов и билирубина. Осуществлено эпитопное картирование АФП.
Однако и в норме в организме взрослых особей роль альфа-фетопротеина может оказаться значимой, в том числе в качестве предшественника биологически активных пептидов. В пользу этого предположения свидетельствует то обстоятельство, что содержание многих факторов роста и полипептидных гормонов, в частности инсулина, в организме взрослого человека находится в пределах тех концентраций, которые хаpaктерны и для АФП. В норме в сыворотке крови взрослых особей АФП обнаруживается лишь в небольших количествах - до 5-10 нг/мл (~10-10М). Однако эта концентрация может оказаться достаточной и функционально значимой.
Таким образом, можно констатировать, что применение новых подходов к изучению структуры и функции АФП, связанных с сочетанием методов компьютерного моделирования, молекулярной динамики и биоинформатики, с выявлением возможных биологически активных участков молекулы АФП, с последующим их химическим синтезом и проверкой их биологической активности, позволяет значительно глубже понять взаимосвязи структуры и функции этого белка.
Работа представлена на научную конференцию с международным участием «Фундаментальные исследования», Доминиканская республика, 5-16 апреля 2006г. Поступила в редакцию 14.03.2006г.
 Статья в формате PDF
251 KB...
Статья в формате PDF
251 KB...
18 04 2024 13:35:59
 Статья в формате PDF
124 KB...
Статья в формате PDF
124 KB...
17 04 2024 4:48:18
 Статья в формате PDF
232 KB...
Статья в формате PDF
232 KB...
16 04 2024 14:43:46
 Статья в формате PDF
254 KB...
Статья в формате PDF
254 KB...
15 04 2024 12:29:49
 Статья в формате PDF
118 KB...
Статья в формате PDF
118 KB...
14 04 2024 1:52:25
 Статья в формате PDF
205 KB...
Статья в формате PDF
205 KB...
13 04 2024 22:40:30
12 04 2024 10:14:59
 Статья в формате PDF
314 KB...
Статья в формате PDF
314 KB...
11 04 2024 0:19:39
 Статья в формате PDF
122 KB...
Статья в формате PDF
122 KB...
10 04 2024 8:15:34
 Статья в формате PDF
245 KB...
Статья в формате PDF
245 KB...
08 04 2024 13:43:45
 Статья в формате PDF
119 KB...
Статья в формате PDF
119 KB...
07 04 2024 0:57:22
 Статья в формате PDF
144 KB...
Статья в формате PDF
144 KB...
06 04 2024 5:32:50
 Статья в формате PDF
124 KB...
Статья в формате PDF
124 KB...
05 04 2024 0:19:50
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
04 04 2024 1:56:19
 Статья в формате PDF
117 KB...
Статья в формате PDF
117 KB...
03 04 2024 18:16:41
 Статья в формате PDF
131 KB...
Статья в формате PDF
131 KB...
01 04 2024 18:23:32
 На основании изучения особенностей трудовой деятельности железнодорожников, учитывая современные принципы оптимального питания, были сформулированы основные требования к ассортименту продуктов лечебно-профилактического питания работников железнодорожных профессий. Даны рекомендации по организации рационального питания. Изучены требования к ассортименту при приготовлении мяса, мясопродуктов, птицы, рыбы, а так же молочных продуктов, круп мучных изделий, хлеба, овощей и фруктов. Представлена информация по пищевой ценности овощей и фруктов и классификация жиров.
...
На основании изучения особенностей трудовой деятельности железнодорожников, учитывая современные принципы оптимального питания, были сформулированы основные требования к ассортименту продуктов лечебно-профилактического питания работников железнодорожных профессий. Даны рекомендации по организации рационального питания. Изучены требования к ассортименту при приготовлении мяса, мясопродуктов, птицы, рыбы, а так же молочных продуктов, круп мучных изделий, хлеба, овощей и фруктов. Представлена информация по пищевой ценности овощей и фруктов и классификация жиров.
...
31 03 2024 10:56:55
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
30 03 2024 15:20:32
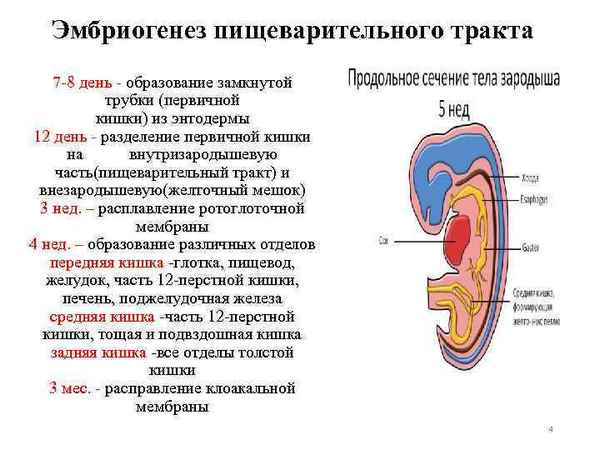 Статья посвящена актуальной морфологической проблеме – формирование слизистой оболочки желудка человека, в раннем эмбриогенезе. Проведен анализ и обобщение научных данных в отечественной и зарубежной литературе о формировании слизистой оболочки желудка. Рассматривается вопрос о процессе формирования врожденных пороков развития желудка.
...
Статья посвящена актуальной морфологической проблеме – формирование слизистой оболочки желудка человека, в раннем эмбриогенезе. Проведен анализ и обобщение научных данных в отечественной и зарубежной литературе о формировании слизистой оболочки желудка. Рассматривается вопрос о процессе формирования врожденных пороков развития желудка.
...
29 03 2024 0:55:38
 Статья в формате PDF
114 KB...
Статья в формате PDF
114 KB...
28 03 2024 0:16:32
 Статья в формате PDF
123 KB...
Статья в формате PDF
123 KB...
27 03 2024 19:22:27
Статья в формате PDF 151 KB...
26 03 2024 11:23:21
 Проводился анализ изменений биоэлектрической активности головного мозга и сверхмедленной активности в нервной, дыхательной и сердечно-сосудистой системах в процессе адаптивного биоуправления с биологической обратной связью по параметрам церебральной гемодинамики и медитации. Осуществлялась регистрация сверхмедленной активности нервной и сердечно-сосудистой систем и локализация биоэлектрической активности нервной системы. Выявлено вовлечение различных мозговых структур в реализацию поведенческих стратегий в группах обучившихся различным видам самоуправления, что говорит о различии механизмов достижения конечного результата. Полученные результаты свидетельствуют о вовлечении кардиореспираторной синхронизации в изменение биоэлектрической активности только при релаксации с помощью адаптивного биоуправления. Осуществлена проверка резонансной гипотезы релаксации, согласно которой при совпадении частот изменения дыхания, биоэлектрической активности мозга, сердечного ритма и сосудистого тонуса происходит усиление активности в вовлекаемых в резонансный ответ структурах.
...
Проводился анализ изменений биоэлектрической активности головного мозга и сверхмедленной активности в нервной, дыхательной и сердечно-сосудистой системах в процессе адаптивного биоуправления с биологической обратной связью по параметрам церебральной гемодинамики и медитации. Осуществлялась регистрация сверхмедленной активности нервной и сердечно-сосудистой систем и локализация биоэлектрической активности нервной системы. Выявлено вовлечение различных мозговых структур в реализацию поведенческих стратегий в группах обучившихся различным видам самоуправления, что говорит о различии механизмов достижения конечного результата. Полученные результаты свидетельствуют о вовлечении кардиореспираторной синхронизации в изменение биоэлектрической активности только при релаксации с помощью адаптивного биоуправления. Осуществлена проверка резонансной гипотезы релаксации, согласно которой при совпадении частот изменения дыхания, биоэлектрической активности мозга, сердечного ритма и сосудистого тонуса происходит усиление активности в вовлекаемых в резонансный ответ структурах.
...
25 03 2024 15:56:32
 Статья в формате PDF
268 KB...
Статья в формате PDF
268 KB...
24 03 2024 6:20:11
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
23 03 2024 10:39:16
 Статья в формате PDF
112 KB...
Статья в формате PDF
112 KB...
22 03 2024 18:58:14
 Статья в формате PDF
255 KB...
Статья в формате PDF
255 KB...
21 03 2024 6:51:11
 Статья в формате PDF
125 KB...
Статья в формате PDF
125 KB...
20 03 2024 1:33:52
 Статья в формате PDF
240 KB...
Статья в формате PDF
240 KB...
19 03 2024 2:50:55
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
18 03 2024 5:28:11
 Статья в формате PDF
122 KB...
Статья в формате PDF
122 KB...
17 03 2024 7:22:30
 Построена октетная электродинамика. Обсуждена возможность объединения механики и электродинамики. Выявлена дальнодействующая структуризация октетного прострaнcтва. Исследуются свойства интервала.
...
Построена октетная электродинамика. Обсуждена возможность объединения механики и электродинамики. Выявлена дальнодействующая структуризация октетного прострaнcтва. Исследуются свойства интервала.
...
16 03 2024 21:37:55
15 03 2024 15:43:43
 Статья в формате PDF
117 KB...
Статья в формате PDF
117 KB...
14 03 2024 18:50:47
 Статья в формате PDF
114 KB...
Статья в формате PDF
114 KB...
13 03 2024 11:35:32
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
12 03 2024 3:21:33
 Статья в формате PDF
320 KB...
Статья в формате PDF
320 KB...
11 03 2024 18:28:31
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::





