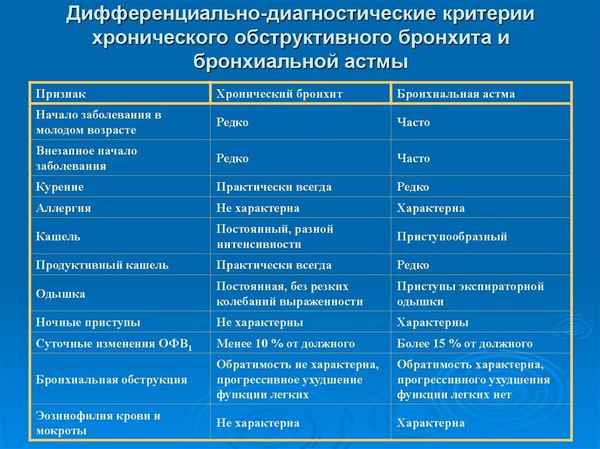
ПРИМЕНЕНИЕ МЕТОДА ДЭВИСА ПРИ ОПРЕДЕЛЕНИИ КОНСТАНТ ДИССОЦИАЦИИ ДИЭЛЕКТРОЛИТОВ

Как было показано в работах [3,4,5,6], расчеты по ионным составляющим в процессах переноса [1,2] (теплопроводность, электрическая проводимость, вязкость и коэффициенты диффузии в растворах сильных и слабых электролитов) лишь на основании ионов, образующихся по первой ступени диссоциации многофункциональных соединений, не совсем объективны. Требуется учет равновесных концентраций всех ионов, находящихся в кислотно-основной системе. Наиболее полную информацию по концентрациям всех частиц можно получить из логарифмических диаграмм «lg C - lg a (SH+)», где lg C представляет концентрации всех ионов в растворе, а lg a (SH+) - активность сольватированного в любом растворителе протона (активность ионов лиония) [3,4,5,6].
При оценке коэффициентов активности наиболее приемлемым является уравнение Дэвиса [8]:
-lgfi = [A·Zi·I0.5/(1+I0.5)]-0.1·I,
так как метод Дебая требует введения а - расстояний наибольшего сближения частиц, которые, строго говоря, являются неопределенными и обычно принимаемыми не более 5·10-8см. Поскольку в растворе все частицы (даже нейтральные молекулы) находятся в сольватированном состоянии (молекулярные сольваты, сольватированные ионы, ассоциированные ионы и т.д.), то даже простая сумма радиусов сольватированных ионов (в первом приближении) не дает полной информации по расстояниям наименьшего сближения ионов и вряд ли будет постоянной для одних и тех же сольватированных катиона и аниона в любом растворителе и равной 5·10-8см.
Коэффициент А определяется соотношением
,
где NA - число Авогадро, kБ - постоянная Больцмана, ε - диэлектрическая проницаемость среды, Т - температура по Кельвину. Для ДМФ получена величина А = 1.6363.
Таким образом, уравнение Дэвиса устраняет неопределенность с расстоянием наибольшего сближения частиц и вполне приемлемо для расчетов коэффициентов активности ионов в водных, тем более в неводных, растворах, где в зависимости от природы растворителя одни и те же ионы хаpaктеризуются различными радиусами сольватированных оболочек. Расчеты термодинамических констант диссоциации электролитов дают более достоверные результаты [7] по сравнению с методом Дебая.
В качестве примера оценки ионных сил, применимости коэффициентов активности по Дэвису и определения термодинамических констант диссоциации ароматических двухосновных кислот в табл. 1 - 5 приведены необходимые данные, включающие некоторые фрагменты в буферных областях от 25 до 75% нейтрализации двухосновных дифеновой (табл. 1), дифенилфталиддикарбоновой (ДФФДК) (табл. 2), о-фталевой (табл. 3), изофталевой (табл. 4) и терефталевой (табл. 5) кислот гуанидином в ДМФА: потенциал электродной системы в зависимости от объема добавленного титранта, логарифмы концентраций всех равновесных частиц, образующихся при диссоциации дикислоты, полный учет которых дает возможность объективной оценки ионной силы, коэффициентов активности по Дэвису и соответствующих величин показателей термодинамических констант диссоциации, определяемых по ур. (1) и (2).
(1)
, (2)
Таблица 1. Данные для определения термодинамических констант диссоциации 4.215·10-3 М раствора дифеновой кислоты титрованием 5.0178·10-2 М раствором гуанидина в ДМФА
|
Vi |
E, B |
-lg a(SH+) |
lg [H2An] |
lg [HAn-] |
lg [An2-] |
I 0,5 |
f1 |
f2 |
pK1 |
pK2 |
||||||||
|
0.5 |
-0.130 |
9.217 |
-2.375 |
-3.058 |
-5.168 |
0.0212 |
0.9247 |
0.7309 |
9.93 |
11.43 |
||||||||
|
0.9 |
-0.156 |
9.665 |
-2.375 |
-2.609 |
-4.719 |
0.0355 |
0.8788 |
0.5959 |
9.95 |
11.94 |
||||||||
|
1.3 |
-0.190 |
10.252 |
-2.727 |
-2.375 |
-4.133 |
0.0475 |
0.8434 |
0.5052 |
9.97 |
12.23 |
||||||||
|
1.7 |
-0.215 |
10.683 |
-3.158 |
-2.375 |
-3.702 |
0.0500 |
0.8361 |
0.4878 |
9.98 |
12.24 |
||||||||
|
2.1 |
-0.239 |
11.096 |
-3.571 |
-2.375 |
-3.288 |
0.0560 |
0.8194 |
0.4499 |
9.98 |
12.27 |
||||||||
|
2.5 |
-0.260 |
11.458 |
-3.933 |
-2.375 |
-2.926 |
0.0669 |
0.7903 |
0.3890 |
10.00 |
12.31 |
||||||||
|
2.9 |
-0.280 |
11.803 |
-4.278 |
-2.375 |
-2.581 |
0.0857 |
0.7439 |
0.3047 |
10.03 |
12.39 |
||||||||
|
3.3 |
-0.300 |
12.148 |
-4.623 |
-2.513 |
-2.375 |
0.0998 |
0.7119 |
0.2552 |
10.18 |
12.45 |
||||||||
На рис. 1, 2, 3, 4, 5 нанесены упомянутые выше логарифмические диаграммы «lg C - lg a (SH+)», позволяющие оценить равновесные концентрации всех заряженных и незаряженных частиц (сольватированных нейтральных молекул и ионов), образующихся при диссоциации кислоты и при титровании ее сильным основанием.
|
|
|
|
Рис. 1. Логарифмическая диаграмма дифеновой кислоты в среде ДМФА ( ◊ - концентрация кислоты Н2Аn, - иона HAn-, ∆ - иона An2-) |
Рис. 2. Логарифмическая диаграмма ДФФДК в среде ДМФА ( ◊ - концентрация кислоты Н2Аn, - иона HAn-, ∆ - иона An2-) |
|
|
|
|
Рис. 3. Логарифмическая диаграмма о-фталевой кислоты в среде ДМФА (◊ - концентрация кислоты Н2Аn, - иона HAn-, ∆ - иона An2-) |
Рис. 4. Логарифмическая диаграмма изофталевой кислоты в среде ДМФА (◊ - концентрация кислоты Н2Аn, - иона HAn-, ∆ - иона An2-) |
Рис. 5. Логарифмическая диаграмма терефталевой кислоты в среде ДМФА (◊ - концентрация кислоты Н2Аn, - иона HAn-, ∆ - иона An2-)
Таблица 2. Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 3.193·10-3 М раствора ДФФДК титрованием 4.6956·10-2 М раствором гуанидина в ДМФА
|
Vi |
E, B |
-lg a(SH+) |
lg [H2An] |
lg [HAn-] |
lg [An2-] |
I 0,5 |
f1 |
f2 |
pK1 |
pK2 |
|
0.4 |
-0.123 |
9.096 |
-2.496 |
-3.089 |
-4.639 |
0.02128 |
0.9246 |
0.7305 |
9.72 |
10.75 |
|
0.8 |
-0.155 |
9.648 |
-2.496 |
-2.537 |
-4.087 |
0.04016 |
0.8649 |
0.5590 |
9.75 |
11.38 |
|
1.2 |
-0.180 |
10.079 |
-2.885 |
-2.496 |
-3.656 |
0.04513 |
0.8502 |
0.5218 |
9.76 |
11.45 |
|
1.6 |
-0.200 |
10.424 |
-3.230 |
-2.496 |
-3.312 |
0.05071 |
0.8342 |
0.4834 |
9.77 |
11.47 |
|
2.0 |
-0.220 |
10.769 |
-3.575 |
-2.496 |
-2.967 |
0.06127 |
0.8052 |
0.4192 |
9.78 |
11.52 |
|
2.4 |
-0.240 |
11.113 |
-3.919 |
-2.496 |
-2.622 |
0.07981 |
0.7580 |
0.3287 |
9.81 |
11.60 |
|
2.8 |
-0.260 |
11.458 |
-4.264 |
-2.714 |
-2.496 |
0.08573 |
0.7439 |
0.3047 |
10.03 |
11.63 |
Таблица 3. Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 0.03718 н. раствора о-фталевой кислоты титрованием гуанидином в среде ДМФА
|
Vi |
E, B |
-lg a(SH+) |
lg[H2An] |
lg [HАn-] |
lg[An2-] |
I 0,5 |
f1 |
f2 |
pK1 |
pK2 |
|
0.4 |
0.055 |
6.0276 |
-1.7307 |
-2.2531 |
-6.6331 |
0.0528 |
0.8254 |
0.4632 |
6.63 |
10.65 |
|
0.8 |
0.040 |
6.2862 |
-1.7307 |
-1.9945 |
-6.3745 |
0.0711 |
0.8003 |
0.4090 |
6.66 |
10.99 |
|
1.2 |
0.036 |
6.3552 |
-1.7307 |
-1.9255 |
-6.3055 |
0.0770 |
0.7831 |
0.3749 |
6.66 |
11.08 |
|
1.8 |
0.023 |
6.5793 |
-1.7307 |
-1.7307 |
-6.0814 |
0.0964 |
0.7534 |
0.3208 |
6.72 |
11.36 |
|
2.2 |
0.020 |
6.6310 |
-1.8117 |
-1.7307 |
-6.0296 |
0.0964 |
0.7334 |
0.2877 |
6.69 |
11.36 |
|
2.7 |
0.011 |
6.7862 |
-1.9669 |
-1.7307 |
-5.8745 |
0.0964 |
0.7333 |
0.2875 |
6.69 |
11.36 |
|
3.1 |
-0.100 |
8.7000 |
-3.8807 |
-1.7307 |
-3.9607 |
0.0975 |
0.7331 |
0.2873 |
6.69 |
11.36 |
|
3.5 |
-0.178 |
10.045 |
-5.2255 |
-1.7307 |
-2.6159 |
0.1189 |
0.7326 |
0.2864 |
6.72 |
11.45 |
|
3.9 |
-0.200 |
10.424 |
-5.6048 |
-1.7307 |
-2.2365 |
0.1445 |
0.6889 |
0.2233 |
6.75 |
11.55 |
|
4.4 |
-0.225 |
10.855 |
-6.0359 |
-1.7307 |
-1.8055 |
0.2014 |
0.5813 |
0.1119 |
6.82 |
11.75 |
|
4.8 |
-0.245 |
11.200 |
-6.3807 |
-2.0007 |
-1.7307 |
0.2053 |
0.5617 |
0.0972 |
7.09 |
11.76 |
|
5.0 |
-0.255 |
11.372 |
-6.5531 |
-2.1731 |
-1.7307 |
0.2013 |
0.5576 |
0.0944 |
7.26 |
11.75 |
Таблица 4. Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 0.01687 н. раствора изофталевой кислоты титрованием гуанидином в среде ДМФА
|
Vi |
E, B |
-lg a(SH+) |
lg [H2An] |
lg [HAn-] |
lg [An2-] |
I 0,5 |
f1 |
f2 |
pK1 |
pK2 |
|
0.2 |
-0.140 |
9.4111 |
-2.0740 |
-2.1829 |
-2.5629 |
0.0935 |
0.7259 |
0.2760 |
9.66 |
10.21 |
|
0.6 |
-0.145 |
9.4989 |
-2.0740 |
-2.0950 |
-2.4750 |
0.1035 |
0.7040 |
0.2438 |
9.67 |
10.33 |
|
1.0 |
-0.149 |
9.5692 |
-2.1232 |
-2.0740 |
-2.4048 |
0.1099 |
0.6904 |
0.2253 |
9.68 |
10.38 |
|
1.4 |
-0.153 |
9.6395 |
-2.1935 |
-2.0740 |
-2.3345 |
0.1161 |
0.6779 |
0.2092 |
9.69 |
10.41 |
|
1.8 |
-0.157 |
9.7098 |
-2.2638 |
-2.0740 |
-2.2642 |
0.1229 |
0.6644 |
0.1928 |
9.69 |
10.43 |
|
2.4 |
-0.175 |
10.0260 |
-2.5800 |
-2.2001 |
-2.0740 |
0.1415 |
0.6297 |
0.1551 |
9.84 |
10.50 |
Таблица 5. Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 0.03250 н. раствора терефталевой кислоты титрованием гуанидином/ДМФА
|
Vi |
E, B |
-lg a(SH+) |
lg [H2An] |
lg [HAn-] |
lg [An2-] |
I 0,5 |
f1 |
f2 |
pK1 |
pK2 |
|
0.5 |
-0.048 |
7.8034 |
-1.789 |
-2.168 |
-5.375 |
0.0583 |
0.8132 |
0.4362 |
8.27 |
11.28 |
|
0.9 |
-0.060 |
8.0103 |
-1.789 |
-1.962 |
-5.168 |
0.0740 |
0.7723 |
0.3545 |
8.29 |
11.55 |
|
1.3 |
-0.070 |
8.1827 |
-1.789 |
-1.789 |
-4.996 |
0.0902 |
0.7334 |
0.2877 |
8.31 |
11.79 |
|
1.7 |
-0.079 |
8.3379 |
-1.944 |
-1.789 |
-4.841 |
0.0903 |
0.7333 |
0.2875 |
8.31 |
11.79 |
|
2.1 |
-0.090 |
8.5276 |
-2.133 |
-1.789 |
-4.651 |
0.0904 |
0.7331 |
0.2872 |
8.31 |
11.79 |
|
2.5 |
-0.125 |
9.1310 |
-2.737 |
-1.789 |
-4.048 |
0.0911 |
0.7314 |
0.2845 |
8.32 |
11.80 |
|
2.9 |
-0.240 |
11.1138 |
-4.720 |
-1.789 |
-2.065 |
0.1591 |
0.5995 |
0.1270 |
8.40 |
12.06 |
|
3.3 |
-0.251 |
11.3034 |
-4.909 |
-1.789 |
-1.875 |
0.1864 |
0.5576 |
0.0944 |
8.43 |
12.16 |
|
3.5 |
-0.253 |
11.3379 |
-4.944 |
-1.789 |
-1.841 |
0.1922 |
0.5493 |
0.0887 |
8.44 |
12.18 |
|
3.7 |
-0.255 |
11.3724 |
-4.978 |
-1.789 |
-1.806 |
0.1983 |
0.5408 |
0.0833 |
8.45 |
12.20 |
|
3.9 |
-0.257 |
11.4067 |
-5.013 |
-1.806 |
-1.789 |
0.2008 |
0.5375 |
0.0812 |
8.46 |
12.21 |
|
4.1 |
-0.261 |
11.4759 |
-5.082 |
-1.875 |
-1.789 |
0.1979 |
0.5414 |
0.0836 |
8.53 |
12.20 |
|
4.3 |
-0.265 |
11.5448 |
-5.151 |
-1.944 |
-1.789 |
0.1954 |
0.5448 |
0.0858 |
8.60 |
12.19 |
Таблица 6. Статистическая обработка определенных величин показателей термодинамических констант диссоциации дикарбоновых ароматических кислот в среде ДМФА
|
№ |
Кислота |
Число точек |
Доверительный интервал |
|
1. |
Дифеновая |
30 |
рК1 = 10.03 ± 0.40; рК2 = 12.22 ± 0.78 |
|
2. |
Дифенилфталид-дикарбоновая |
27 |
рК1 = 9.82 ± 0.45; рК2 = 11.44 ± 0.69 |
|
3. |
о - Фталевая |
30 |
рК1 = 6.947 ± 0.315; рК2 = 11.220 ± 0.566 |
|
4. |
Изофталевая |
25 |
рК1 = 9.791 ± 0.140; рК2 = 10.327 ± 0.191 |
|
5. |
Терефталевая |
41 |
рК1 = 8.458 ± 0.193; рК2 = 11.697 ± 0.505 |
Статистическая обработка экспериментально определенных термодинамических констант диссоциации ароматических дикарбоновых кислот в среде ДМФА приводит к доверительным интервалам, внутри которых с вероятностью 0.95 находятся экспериментальные величины рК1 и рК2 (табл.6).
Таким образом, обоснована применимость уравнения Дэвиса, свободного от неопределенности расстояний наибольшего сближения ионов по Дебаю-Хюккелю, к концепции теоретической оценки коэффициентов активности и экспериментального определения термодинамических констант диссоциации ароматических кислот в среде органических растворителей при раздельной и совместной нейтрализации обеих кислотных групп.
СПИСОК ЛИТЕРАТУРЫ:
- Балданов М.М., Балданова Д.М. Жигжитова С.Б., Танганов Б.Б. // ДАН ВШ России. -2006. -№ 1. -С.25.
- Дашиев Р.З., Балданов М.М., Танганов Б.Б.//ДАН ВШ России.-2005.-.№1.-С.12
- Танганов Б.Б., Алексеева И.А.//Вестник ВСГТУ.-2005.-Вып.2.-С.5; -Вып.3.-С.5.
- Танганов Б.Б., Алексеева И.А. // ЖОХ.-2005.-Т.75.-Вып.11.-С.1775.
- Танганов Б.Б., Алексеева И.А. // ЖОХ.-2006.-Т.76.-Вып.11.-С.1800.
- Танганов Б.Б., Алексеева И.А. // Вестник БГУ.-Серия «Химия».-2006.-С.70.
- Танганов Б.Б. // ЖОХ.-2007.-Т.77.-Вып.8.-С.1238.
- Davies C.W. // J. Chem.Soc. - 1938. -P.2093.
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
24 04 2024 6:21:58
 Статья в формате PDF
213 KB...
Статья в формате PDF
213 KB...
23 04 2024 13:18:20
 Статья в формате PDF
130 KB...
Статья в формате PDF
130 KB...
22 04 2024 23:21:32
 Статья в формате PDF
107 KB...
Статья в формате PDF
107 KB...
21 04 2024 14:58:35
 Статья в формате PDF
253 KB...
Статья в формате PDF
253 KB...
20 04 2024 4:52:53
 Статья в формате PDF
127 KB...
Статья в формате PDF
127 KB...
19 04 2024 21:57:14
 Статья в формате PDF
119 KB...
Статья в формате PDF
119 KB...
18 04 2024 15:49:49
17 04 2024 21:52:15
 Статья в формате PDF
264 KB...
Статья в формате PDF
264 KB...
15 04 2024 6:46:39
 Статья в формате PDF
250 KB...
Статья в формате PDF
250 KB...
14 04 2024 8:57:11
 Разработана методика выделения и очистки глюкоамилазы, включающая стадии ультрафильтрации на мембране УФМ-50, осаждения изопропиловым спиртом и гель-хроматографии на сефадексах G-25 и G-150, которая позволила получить гомогенный препарат глюкоамилазы из Saccharomyces cerevisiae ЛВ-7 с 70-кратной степенью чистоты; кажущаяся молекулярная масса фермента 99,8 кДа.
...
Разработана методика выделения и очистки глюкоамилазы, включающая стадии ультрафильтрации на мембране УФМ-50, осаждения изопропиловым спиртом и гель-хроматографии на сефадексах G-25 и G-150, которая позволила получить гомогенный препарат глюкоамилазы из Saccharomyces cerevisiae ЛВ-7 с 70-кратной степенью чистоты; кажущаяся молекулярная масса фермента 99,8 кДа.
...
13 04 2024 1:52:36
 Изучена коагулирующая способность фторида аммония при выделении каучука из латекса СКС- 30АРК. Исследовано влияние температуры и концентрации раствора фторида аммония на полноту коагуляции. Проведена оценка свойств резиновых смесей и вулканизатов на основе каучука СКС-30 АРК, выделенного из латекса фторидом аммония.
...
Изучена коагулирующая способность фторида аммония при выделении каучука из латекса СКС- 30АРК. Исследовано влияние температуры и концентрации раствора фторида аммония на полноту коагуляции. Проведена оценка свойств резиновых смесей и вулканизатов на основе каучука СКС-30 АРК, выделенного из латекса фторидом аммония.
...
12 04 2024 6:33:39
 Статья в формате PDF
173 KB...
Статья в формате PDF
173 KB...
11 04 2024 1:43:47
 Статья в формате PDF
308 KB...
Статья в формате PDF
308 KB...
10 04 2024 13:40:27
 Статья в формате PDF
364 KB...
Статья в формате PDF
364 KB...
08 04 2024 8:35:25
 Статья в формате PDF
128 KB...
Статья в формате PDF
128 KB...
07 04 2024 13:27:39
 Статья в формате PDF
102 KB...
Статья в формате PDF
102 KB...
06 04 2024 19:45:48
05 04 2024 14:43:28
 Статья в формате PDF
114 KB...
Статья в формате PDF
114 KB...
02 04 2024 9:37:52
 Статья в формате PDF
233 KB...
Статья в формате PDF
233 KB...
01 04 2024 10:38:13
 Статья в формате PDF
262 KB...
Статья в формате PDF
262 KB...
31 03 2024 12:14:17
 Статья в формате PDF
263 KB...
Статья в формате PDF
263 KB...
30 03 2024 3:36:40
 Статья в формате PDF
127 KB...
Статья в формате PDF
127 KB...
29 03 2024 13:36:46
 На основании диагностических признаков приводятся доказательства, указывающие на то, что Chytridiomycosis существует в популяциях Rana arvalis на Среднем Урале. Показана методика обнаружения заболевания по аномалиям ротового аппарата личинок и отслеживания динамики частоты встречаемости его в популяции. В экстремальных условиях инфекция поражает ослабленных и ведет к их выбpaковке, что приводит к ускорению адаптации популяции в целом в быстро изменяемой среде.
...
На основании диагностических признаков приводятся доказательства, указывающие на то, что Chytridiomycosis существует в популяциях Rana arvalis на Среднем Урале. Показана методика обнаружения заболевания по аномалиям ротового аппарата личинок и отслеживания динамики частоты встречаемости его в популяции. В экстремальных условиях инфекция поражает ослабленных и ведет к их выбpaковке, что приводит к ускорению адаптации популяции в целом в быстро изменяемой среде.
...
28 03 2024 9:54:38
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
27 03 2024 16:46:13
 Статья в формате PDF
135 KB...
Статья в формате PDF
135 KB...
26 03 2024 16:52:37
 Проведена инвентаризация лихенофлоры Республики Татарстан (РТ). Показана роль особо охраняемых природных территорий в сохранении флористического разнообразия. Дан спектр семейств редких видов во флоре обследованной территории и анализ состава географических элементов. Рассмотрено распределение редких видов по основным типам местообитаний. Даются некоторые сведения о редких и исчезающих лишайниках для включения в Красную книгу РТ.
...
Проведена инвентаризация лихенофлоры Республики Татарстан (РТ). Показана роль особо охраняемых природных территорий в сохранении флористического разнообразия. Дан спектр семейств редких видов во флоре обследованной территории и анализ состава географических элементов. Рассмотрено распределение редких видов по основным типам местообитаний. Даются некоторые сведения о редких и исчезающих лишайниках для включения в Красную книгу РТ.
...
24 03 2024 0:13:22
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
23 03 2024 1:19:34
22 03 2024 16:48:32
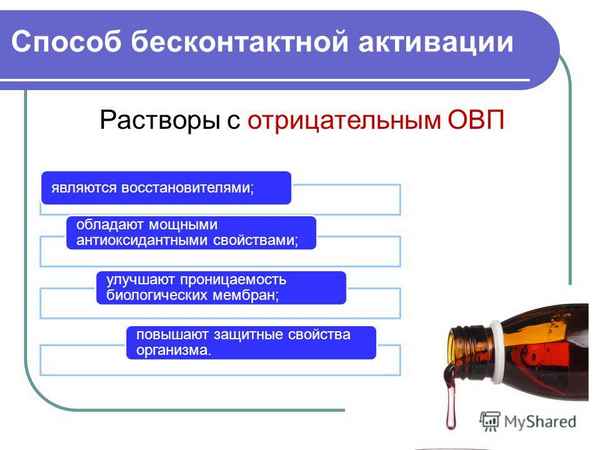 Исследованы водные растворы неорганических соединений бесконтактно активированные в бездиафрагменном электролизере. Активация в большинстве случаев сопровождается уменьшением окислительно-восстановительного потенциала растворов. Показано, что релаксация бесконтактно активированных растворов начинается спустя 30-40 минут по завершении активации и протекает в колебательном режиме. Растворы бихромата калия при активации приобретают отрицательный окислительно-восстановительный потенциал, спектр поглощения растворов при этом не изменяется. Для растворов перманганата калия наблюдается противоположный эффект. Изменения окислительно-восстановительного потенциала невелики, однако изменение спектра поглощения раствора свидетельствует об образовании продукта, не имеющем аналогов при химическом восстановлении KMnO4.
...
Исследованы водные растворы неорганических соединений бесконтактно активированные в бездиафрагменном электролизере. Активация в большинстве случаев сопровождается уменьшением окислительно-восстановительного потенциала растворов. Показано, что релаксация бесконтактно активированных растворов начинается спустя 30-40 минут по завершении активации и протекает в колебательном режиме. Растворы бихромата калия при активации приобретают отрицательный окислительно-восстановительный потенциал, спектр поглощения растворов при этом не изменяется. Для растворов перманганата калия наблюдается противоположный эффект. Изменения окислительно-восстановительного потенциала невелики, однако изменение спектра поглощения раствора свидетельствует об образовании продукта, не имеющем аналогов при химическом восстановлении KMnO4.
...
21 03 2024 16:46:17
 Статья в формате PDF
123 KB...
Статья в формате PDF
123 KB...
20 03 2024 16:34:26
 Исследование гормонального баланса в группах пациенток с I-IIA и IIB-IIIA стадиями распространения paка молочной железы позволило обнаружить прогрессирующее снижение содержания в крови прогестерона, коррелирующее со стадией распространения опухолевого процесса. Уровень эстриола снижался в равной мере в обеих группах наблюдения пациентов (I-IIA и IIB-IIIA стадиями распространения неоплазии) по сравнению с показателями контроля. Указанные сдвиги гормонального баланса наблюдались в разных возрастных группах от 29 до 49 лет, достигая максимальных сдвигов в пре- и менопаузальный периоды. Содержание эстрадиола в крови оставалось в пределах нормы при I-IIA стадиях развития заболевания, резко возрастая при метастатической форме paка молочной железы. Мониторинг показателей содержания в крови прогестерона и эстрадиола может быть использован как один из способов оценки эффективности комплексной терапии заболевания и степени распространения неоплазии при paке молочной железы.
...
Исследование гормонального баланса в группах пациенток с I-IIA и IIB-IIIA стадиями распространения paка молочной железы позволило обнаружить прогрессирующее снижение содержания в крови прогестерона, коррелирующее со стадией распространения опухолевого процесса. Уровень эстриола снижался в равной мере в обеих группах наблюдения пациентов (I-IIA и IIB-IIIA стадиями распространения неоплазии) по сравнению с показателями контроля. Указанные сдвиги гормонального баланса наблюдались в разных возрастных группах от 29 до 49 лет, достигая максимальных сдвигов в пре- и менопаузальный периоды. Содержание эстрадиола в крови оставалось в пределах нормы при I-IIA стадиях развития заболевания, резко возрастая при метастатической форме paка молочной железы. Мониторинг показателей содержания в крови прогестерона и эстрадиола может быть использован как один из способов оценки эффективности комплексной терапии заболевания и степени распространения неоплазии при paке молочной железы.
...
19 03 2024 11:36:43
 Статья в формате PDF
835 KB...
Статья в формате PDF
835 KB...
18 03 2024 23:48:17
 Статья в формате PDF
251 KB...
Статья в формате PDF
251 KB...
17 03 2024 10:14:43
 Статья в формате PDF
196 KB...
Статья в формате PDF
196 KB...
16 03 2024 21:35:28
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::