МОЛЕКУЛЯРНО-КЛЕТОЧНЫЕ МЕХАНИЗМЫ ИНАКТИВАЦИИ СВОБОДНЫХ РАДИКАЛОВ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
•ОО- +•ОО- + 2Н+ → О2 + НООН
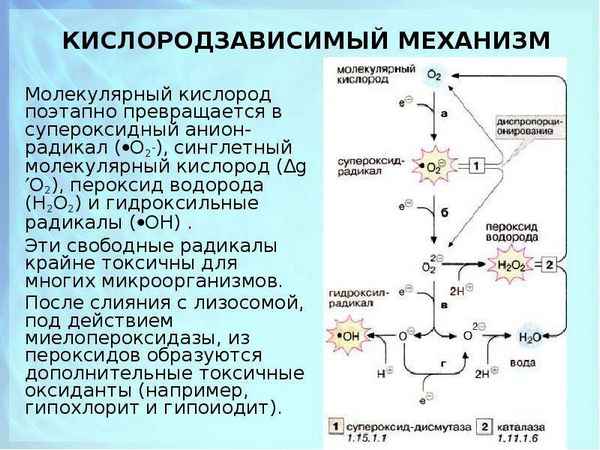
При участии СОД обеспечивается инактивация активных форм кислорода, образуемых в ходе реакций переноса электронов, при гипоксиях различного генеза, на фоне гипербарической оксигенации и других патогенных факторов [7,8].
Судьба перекиси водорода, образуемой в процессе реакций дисмутации, различна.
Частично перекись водорода разлагается при участии каталазы, проявляющей активность почти во всех клетках организма человека, особенно в печени, почках, эритроцитах:
2Н2О2 → Н2О + О2
В печени, почках, нейтрофильных лейкоцитах обнаруживается пероксидазная активность, обеспечивающая инактивацию перекиси водорода в следующей реакции:
Н2О2 + Н2О2 → 2 Н2О2 + RО2
В нейтрофильных лейкоцитах имеется миелопероксидаза; в эритроцитах, печени, хрусталика глаза содержится глутатионпероксидаза, окисляющие соответственно галогены с образованием бактерицидных радикалов или восстановленный глутатион [23]. Миелопероксидаза фагоцитов катализирует реакцию образования гипохлорита с высокой бактерицидной активностью:
Н2О2 + Cl- → Н2О + ClO- (гипохлорит)
Гипохлорит разрушает стенку бактериальных клеток [28,29].
В присутствии ионов двухвалентного железа перекись разлагается в реакции Фентона с образованием гидроксильного радикала (OH•):
Н2О2 + Fe2+ → Fe3+ + OH- + OH•
Радикалы гидроксила чрезвычайно активны и разрушают различные по структуре молекулы [3,4,5,14,16].
Исключительно важным моментом эффективности ферментного звена антиоксидантной системы является сбалансированность активности СОД, каталазы и пероксидазы [8,11]. Подавление активности одного из ферментов антиоксидантной системы может привести к избыточному накоплению активных форм кислорода и деструкции клеток.
Установлено, что накопление в среде перекиси водорода ведет к инактивации СОД. Полагают, что уровень активности внутриклеточных ферментативных антиоксидантных систем генетически детерминирован, причем избыточное накопление в клетках супероксидного анион-радикала или перекиси водорода сопровождается депрессией участков генома, ответственного за активность внутриклеточных ферментативных антиоксидантных систем [8,12]. У человека ген, кодирующий синтез СОД, локализован в 21-й хромосоме. При сохраненной активности каталазы активность СОД не подавляется.
В нормальных условиях у человека содержание ферментных антиоксидантов не зависит от возраста, пола, массы тела. В то же время при различных патологических состояниях концентрация и активность ферментов антиоксидантной системы может изменяться в различных направлениях.
Как известно, главной дышащей органеллой клетки является митохондрия, содержащая большое количество активных ферментов и коферментов в дыхательной цепи и являющаяся потенциальным источником свободных радикалов при одноэлектронном восстановлении кислорода [32,33,34,35]. В связи с этим митохондрии обладают последовательной системой защиты от активных форм кислорода, включающей следующие этапы:
- Поглощение кислорода активной цитохромоксидазой, обеспечивающей четырехэлектронное восстановление кислорода с образованием воды.
- Реокисление О2- в кислород под действием окисленного цитохрома с, десорбированного с внутренней митохондриальной мембраны в межмембранное прострaнcтво.
- Tрaнcформация О2- под влиянием СОД митохондриального матрикса в перекись водорода с последующей утилизацией перекиси при участии глутатионпероксидазы и каталазы в матриксе митохондрий.
- Удаление активных форм кислорода в матриксе при участии токоферола, КоQH2, аскорбита и других антиоксидантов [34,37].
Важнейшим антиоксидантом митохондрий является коэнзим Q10, или убихинон (вездесущий хинон), содержащийся пpaктически во всех тканях организма. Как известно, коэнзим Q10 является переносчиком электронов в дыхательной цепи, в то же время эффективно защищает липиды биологических мембран и липопротеиды крови от перекисного окисления, пpeдoxpaняет ДНК и белки от окислительной модификации [17,20].
Индукция активных форм кислорода возникает и в процессе окислительно - восстановительных, оксигеназных реакций в микросомах, обладающих и определенным механизмом защиты от свободных радикалов.
В настоящее время известно более 1000 ферментов класса оксигеназ и около 1200 генов, кодирующих их структуру [25]. Оксигеназы, как известно, разделяются на диоксигеназы, внедряющие 2 атома кислорода в молекулу субстрата, и монооксигеназы, катализирующие реакции с включением одного атома в субстрат, в то время как другой атом восстанавливается до воды. Наиболее многочисленными являются монооксигеназые реакции с участием цитохрома Р-450 [10,25]. У человека суперсемейство цитохрома Р-450 представлено 57 функционально активными генами [42]. Монооксигеназные реакции играют важную роль не только в инактивации ксенобиотиков, но и в метаболизме витаминов, жирных кислот, нейротрaнcмиттеров, стероидных гормонов и др. соединений [10,25]. В настоящее время очевидно, что образование активных форм кислорода происходит и в процессах микросомального окисления.
Установлено, что в качестве восстановителя в монооксигеназных реакциях участвует НАД•Н или НАДФ•Н. Предполагается, что образование активных форм кислорода возможно при участии «НАДФ•Н - цитохром Р-450 - редуктаза → цитохром в5», а также при распаде реакционных пероксо- (Fe3+ - О2-) и гидропероксокомплексов (Fe3+ - НО2), (Fe2+ - НО2). Продукция активных метаболитов кислорода зависит от изоформы Р-450, рН среды, концентрации кислорода, наличия восстановителей и субстрата окислителя [7,25].
В связи с постоянным образованием свободных радикалов микросомы обладают специализированными системами антиоксидантной защиты:
- во-первых, активные формы кислорода (АФК) вызывают деградацию определенных изоформ цитохрома Р-450, инициирующего образование свободных радикалов;
- во-вторых, АФК вызывают экспрессию генов, кодирующих ферменты антиоксидантной защиты клеток [11,14,24,25].
Касаясь особенностей функционирования ферментного звена антиоксидантной системы, следует отметить, что реакции дисмутации супероксид анион - радикала и разложения перекиси водорода экзотермичны, а катализирующие эти реакции СОД и каталаза не нуждаются в кофакторах, что делает их активность не зависящей от функционирования других клеточных структур. СОД ускоряет спонтанную реакцию в 200 раз.
Обнаружено несколько изоэнзимных форм СОД, отличающихся строением активного центра. У эукариотов Cu-, Zn-содержащая СОД локализуется в основном в цитозоле эритроцитов, в межмембранном прострaнcтве митохондрий, в цитоплазме и ядре нервных клеток. Фермент чувствителен к цианиду, представляет собой металлопротеид с ММ 32000-33000, состоит из двух субъединиц, каждая из которых связывает 1 атом Cu и 1 атом Zn [12,31].
Mn-СОД локализована в митохондриях печени и миокарда эукариот, вблизи анионных каналов. Для микроорганизмов хаpaктерны железосодержащий и марганецсодержащий изоферменты. Mn-СОД состоит из 4 субъединиц с ММ 20 000 каждая, механизм действия энзима, вероятно, подобен действию Cu-, Zn-СОД-фермента, то есть металл в активном центре попеременно меняет свою валентность: Mn3+, Mn2+ [2,12,22,23,27].
Супероксиддисмутазную активность могут проявлять комплексы меди с аминокислотами и пептидами, а также многие медьсодержащие белки.
Описанные выше изоферментные формы СОД являются внутриклеточными ферментами, в межклеточной жидкости (плазма крови, лимфа, синовиальная жидкость) они разрушаются в течение 5-10 минут. В то же время обнаружена экстрацеллюлярная высокомолекулярная форма СОД (ММ 120 000 Д), хорошо связывающаяся гепаринсульфатом гликокаликса эндотелиоцитов, локально защищает их от свободных радикалов. Экстрацеллюлярная СОД не связывается с лейкоцитами и эритроцитами, не участвует в регуляции продукции активных форм кислорода гранулоцитами в процессе киллинга [13]. Эктрацеллюлярная СОД локально защищает эндотелиоциты от повреждения активными радикалами кислорода [28,29].
СОД существенно ускоряет дисмутации супероксид анион-радикала. Однако, несмотря на высокую специфичность фермента, при определенных условиях Cu-СОД может взаимодействовать с перекисью водорода и выступать в качестве прооксиданта.
В последние годы были синтезированы модифицированные препараты СОД и каталазы, ассоциированные с иммуноглобулинами, сывороточным альбумином, высокомолекулярными спиртами, в частности, полиэтиленгликолями, что обеспечивало стабильность ферментов и длительность их циркуляции в крови [26]. Подобные ассоциированные формы фермента нашли применение в эксперименте при эндотоксикозе, инфаркте миокарда, региональной ишемии, ожогах кожи, а также при стрессовых и воспалительных повреждениях тканей [1, 15, 18, 21, 22, 23, 26].
Церулоплазмин или гoлyбая феррооксидаза - гликопротеид сыворотки крови, образующийся в печени, катализирует реакцию:
4Fe2+ + 4H+ O2 → 4Fe3+ + H2O,
способствует окислению полиаминов, полифенолов, аскорбиновой кислоты, возможно, участвует в трaнcпорте меди. Прямая антиоксидантная функция определяется супероксиддисмутазной и ферриоксидазной активностью, а непрямые антиоксидантные свойства связаны с окислением Fe2+ и аскорбината, потенциальных источников супероксидного анион-радикала. Это основной реактант острой фазы воспаления [16].
Как указывалось, в процессе дисмутации супероксидного анион-радикала образуется перекись водорода, восстанавливаемая до воды в основном каталазой и глутатионпероксидазой [12,22,27].
Каталаза - хромопротеид с ММ около 240 000 Д, состоит из 4 субъединиц, имеющих по одной группе гема, локализуется в основном в пероксисомах, частично - в микросомах и в меньшей мере - в цитозоле. Полагают, что каталаза не имеет высокого сродства к перекиси водорода и не может эффективно обезвреживать это соединение при низких концентрациях, имеющихся в цитозоле. В пероксисомах, где концентрация перекиси водорода высока, каталаза активно разрушает ее.
Разложение перекиси водорода каталазой осуществляется в два этапа:
Fe3+-каталаза + 2 H2O2 → окисленная каталаза + H2O2 → Fe3+-каталаза + H2O2 + O2.
При этом в окисленном состоянии каталаза работает как пероксидаза. Субстратами в пероксидазной реакции могут быть этанол, метанол, формиат, формальдегид и другие доноры водорода [12,22,27].
Следует отметить, что около 0,5% кислорода, образующегося в результате разложения перекиси водорода, возникает в возбужденном, синглетном состоянии и таким образом в процессе разложения перекиси водорода вновь генерируются активные формы кислорода.
Активности каталазы и СОД коррелируют между собой, что может быть связано с переключением потока электронов с одной цепи трaнcпорта на другую. В этих условиях СОД и каталаза действуют как звенья одной системы утилизации кислорода, размещенные в разных участках клетки.
Максимальная концентрация каталазы обнаружена в эритроцитах [12,22,27,28,29].
Важнейшей системой инактивации свободных радикалов являются восстановленный глутатион и комплекс ферментов - глутатионпероксидазы, глутатионтрaнcферазы и глутатионредуктазы.
Глутатион синтезируется в печени, откуда трaнcпортируется в различные органы и ткани, обеспечивает восстановление дисульфидных групп белков, дигидроаскорбиновой кислоты, с участием глутатионтрaнcферазы образует конъюгаты в печени с электрофильными соединениями и последующим выведением их с мочой [6,51].
Инактивация перекиси водорода в клетках обеспечивается также глутатионпероксидазой (ГПО), последняя является Se-содержащим ферментом, около 70% ее локализовано в цитоплазме и около 30% - в митохондриях всех клеток млекопитающих [19]. Глутатионпероксидаза - белок с ММ 84000-88000, состоит из 4 идентичных субъединиц, каждая из которых включает 1 атом Se.
Глутатионпероксидаза катализирует реакцию восстановления гидроперекиси с помощью глутатиона, обладает широкой субстратной специфичностью по отношению к гидроперекисям, но абсолютно специфична к глутатиону [30].
Сродство глутатионпероксидазы и перекиси водорода выше, чем у каталазы, поэтому первая более эффективно работает при низких концентрациях субстрата, в то же время в защите клеток от окислительного стресса, вызванного высокими концентрациями перекиси водорода, ключевая роль принадлежит каталазе. Последнее особенно четко продемонстрировано на эндотелиальных клетках.
В клетках млекопитающих, кроме Se-зависимой ГПО, выявлена ГПО без Se с ММ 39000-46000, катализирующая восстановление гидроперекисей органических соединений, в том числе и полиненасыщенных жирных кислот, но ее эффективность в отношении перекиси водорода чрезвычайно низка.
Стресс через a-адренергические рецепторы, цАМФ и протеинкиназу стимулирует активность ГПО [19].
Бесселеновая глутатионпероксидаза локализована в митохондриальных мембранах печени, почек, сердца, в то время как селеновая - в эритроцитах.
ГПО принадлежит активная роль в защите лизосомальных мембран от перекисного окисления [40,44].
ГПО элиминирует перекиси стеринов и нуклеиновых кислот, является адаптивным ферментом, активность которого регулируется продуктами липопероксидации и активными формами кислорода. Важным компонентом антиоксидантной системы является глутатионтрaнcфераза, ингибирующая инициацию ПОЛ и обезвреживающая токсические метаболиты ПОЛ. Фермент активируется через цАМФ. Тканевая ГПО, по мнению ряда авторов, представляет собой изоформу глутатионтрaнcферазы [11,19].
В клетках млекопитающих выделяют семейство мультифункциональных белков - глутатионтрaнcфераз, использующих глутатион для конъюгации с гидрофобными соединениями и восстановление органических перекисей. Эти ферменты локализованы в основном в цитозоле клеток. Основная функция глутатионтрaнcфераз в печени - защита клеток от ксенобиотиков и продуктов ПОЛ посредством их восстановления при участии глутатиона [23].
НИЗКОМОЛЕКУЛЯРНЫЕ АНТИОКСИДАНТЫ
Класс низкомолекулярных антиоксидантов включает разнообразные соединения, отличающиеся по структуре и источникам их образования. К ним относятся глутатион, аскорбиновая кислота, мочевина, мочевая кислота, низкомолекулярные антиоксиданты липидной фазы [4,5,9,36,51].
Важную роль в инактивации свободных радикалов отводят внутриклеточным и внеклеточным ловушкам, обеспечивающим обрыв цепи свободнорадикального окисления [38,39,48].
Эффективными «перехватчиками» радикалов являются фенольные антиоксиданты, в частности, простые фенолы, нафтолы и окси-производные других ароматических соединений. В настоящее время выделено несколько тысяч фенольных соединений, среди которых выраженным антиоксидантным эффектом обладают витамины Е и К, убихиноны, триптофан и фенилаланин, а также большинство растительных и животных пигментов, в частности, каротиноиды, флавоноиды, фенокарбоксильные кислоты [43,45,46,47].
Фенольные антиоксиданты (ликопен, каротины, билирубин и a-токоферол) служат ингибиторами супероксидного анион-радикала, синглетного кислорода, гидроксильного радикала [24,25].
Значение неферментных низкомолекулярных антиоксидантов трудно переоценить, особенно в условиях окислительного стресса. Когда возникает быстрое истощение конститутивного пула ферментов свободными радикалами и необходимо значительное время для их синтеза de novo [10,14,21].
Большое биологическое значение для человека имеет антиоксидант - a-токоферол. он жирорастворим, его основная локализация - гидрофобный слой биологических мембран; инактивирует главным образом радикалы жирных кислот.
Около 50% клеточного токоферола локализовано в ядре, 30% - в мембранах митохондрий, 20% - в микросомальной мембране.
Недостаток витамина Е способствует деструкции мембран и экскреции креатина с мочой. Витамин Е - мощный антимутаген, в физиологических концентрациях является регулятором тканевого дыхания, а антиоксидантные свойства его проявляются при 10-15-кратном повышении этих доз [39]. Кроме a-токоферола, в клетках содержатся водорастворимые антиоксиданты, в том числе аскорбат, которые реагируют с более широким спектром свободных радикалов и поддерживают содержание токоферола.
Аскорбиновая кислота может выступать в качестве донора и акцептора ионов водорода благодаря наличию в структуре двух фенольных групп, ее антиоксидантные свойства хаpaктеризуются широким спектром инактивирующего действия на различные свободные радикалы. Аскорбиновая кислота превосходит другие антиоксиданты плазмы крови в защите липидов от перекисного окисления [37].
Обращает на себя внимание тот факт, что в присутствии ионов Fe или Cu аскорбиновая кислота становится мощным прооксидантом.
Антиоксидантные свойства аскорбиновой кислоты связаны с ее оксиредуктазными переходами. Теряя атом водорода, аскорбиновая кислота превращается в радикал - монодегидроаскорбиновую кислоту, проявляющую прооксидантный эффект, потеря еще одного атома водорода приводит к образованию дегидроаскорбиновой кислоты. При этом участвует фермент, содержащий медь - аскорбатоксидаза [50,51].
Известно, что аскорбиновая кислота восстанавливает продукт окисления токоферола - a-токофероксид в a-токоферол. Витамины P и C также восстанавливаются. Аскорбиновая кислота более стабильна в присутствии метилметионина, обеспечивающего не только восстановление дегидроаскорбиновой кислоты, но и полноценность функционирования глутатионового звена антиоксидантной системы. Аскорбат играет важную роль среди водорастворимых антиоксидантов в защите липопротеидов крови [12,22,27].
Важная роль в антиоксидантной защите организма отводится SH-содержащим соединениями, к числу которых относятся помимо трипептида - глутатиона цистеин, цистин и метионин.
SH-соединениям отводится ведущая роль в защите клеток от радикала OH•. В связи с коротким периодом жизни и радиусом диффузии OH• в биологических системах указанное соединение не подвергается ферментативной инактивации и в то же время может оказать сильное цитотоксическое и мутагенное действие, которое определяет значимость SH-содержащих соединений - активных перехватчиков OH•-радикалов.
При различных стрессовых воздействиях, под влиянием эффектов токсических и ферментативных факторов патогенности различных инфекционных возбудителей, в частности, чумы, анаэробной газовой инфекции, стрептостафилококковой групп бактерий, наблюдается обратимая окислительная модификация SH-групп, приводящая к увеличению дисульфидных групп, что является типовой неспецифической реакцией организма на действие экстремального раздражителя [41].
Однако изменение соотношения восстановленных и окисленных тиогрупп в сторону преобладания последних изменяет состояние проницаемости клеточных мембран, их адгезивные свойства, приводит к резкому угнетению функции серосодержащих ферментов или коферментов (липоевой кислоты, коэнзима А, глутатиона), нарушению работы тиоловых металлопротеидов (цитохром P-450), ряда гормональных рецепторов и факторов трaнcкрипции [42].
Антиоксидантные свойства глутатиона определяются как непосредственным взаимодействием с АФК и обменными реакциями с дисульфидными связями, так и функционированием ряда ферментов глутатионового цикла, из которых главная глутатионпероксидаза и глутатион - S - трaнcфераза [51]. Глутатион играет важную роль в антиоксидантной защите не только при гипоксических, но и гипероксических состояниях, ограничивающих свободнорадикальное окисление. Глутатион обеспечивает формирование антиоксидантного потенциала в эритроцитах, кроветворных клетках, поддерживает пул восстановительного аскорбата [50,51].
Из биофлавоноидов наиболее изучены антиоксидантные свойства кверцитина и рутина, способных за счет ортогидроксилов фенольного кольца С быть донорами водорода. Биофлавоноиды гасят супероксидный анион-радикал, проявляют антиатерогенное, гипохолестеринемическое действие.
К низкомолекулярным антиоксидантам относятся мочевина и мочевая кислота. Как известно, образование мочевины осуществляется в орнитиновом цикле из аммиака, хотя источником мочевины могут быть гуанидиновые соединения. В эритроцитах мочевина связывается с гемоглобином, в сыворотке крови - с альбумином; она легко проникает через гистогематический барьер. Антиоксидантный эффект мочевины связан со стабилизацией мембран и модификацией ферментов, тем самым сокращая число железосодержащих центров перекисного окисления липидов [9].
Окислительно-восстановительные реакции мочевой кислоты тесно связаны с аскорбиновой кислотой. Мочевая кислота, как и аскорбат, способна вступать в обменные реакции с АФК, ингибировать ПОЛ, оказывает выраженный протективный эффект по отношению к Fe- и рН - индуцированному окислению аскорбата в сыворотке крови [6].
Резюмируя вышеизложенное в целом, следует заключить, что в целостном макроорганизме находятся в динамическом равновесии системы генерации свободных радикалов, в частности, свободных форм кислорода, и антирадикальной, антиоксидантной защиты.
Нарушение этого взаимодействия нередко приводит к дестабилизации биологических мембран, активации процессов липопероксидации, расстройствам гемостаза, фибринолиза, активации каликреинкининовой системы, системы комплемента, нарушению васкуляризации, оксигенации и трофики тканей, потенцированию специфических цитопатогенных эффектов воздействия бактериальных токсинов. Антиоксиданты блокируют активацию протоонкогенов, нормализуют иммунный статус [16,40].
Ослабление антиоксидантной защиты клеток может быть вызвано недостаточным поступлением в организм неферментных антиоксидантов, в частности, a-токоферола. Недостаточное поступление в организм селена может быть одной из причин нарушения активности селензависимой глутатионпероксидазы, дефицит Cu2+ и Zn2+ резко снижают активность СОД и резко повышают чувствительность к оксидантному повреждению.
Следует отметить, что изменения активности антиоксидантных ферментов зависят от интенсивности образования активных форм кислорода (АФК): в случае умеренного возрастания АФК возникает, как правило, активация ферментного звена антиоксидантной системы, при чрезмерном возрастании уровня свободных радикалов нередко происходит, подавление ферментативного звена радикальной защиты клеток [16,21].
Как известно, в условиях окислительного стресса, развивающегося при гипоксии, ишемии, гипероксии, действии стрессовых раздражителей бактериальной природы - эндо-, экзотоксинов, ферментов и токсинов бактерий, ферментативная защита оказывает менее эффективное по сравнению с протекторным действием низкомолекулярных антиоксидантов [14,41].
Последнее обусловлено быстрой инактивацией конститутивного пула ферментов антиоксидантной системы свободными радикалами и значительным временем, необходимым для индукции их синтеза. В связи с этим повышается значимость низкомолекулярных антиоксидантов, что обусловлено их избыточным содержанием в клетках и биологических жидкостях, а также достаточно высокой миграционной способностью.
Однако при чрезмерном образовании инициаторов свободнорадикального окисления может истощиться пул и неферментных антиоксидантов, которые, выполнив роль ловушки свободных радикалов, превращаются в неактивные димерные и другие формы.
СПИСОК ЛИТЕРАТУРЫ
- Биленко М.В. Ишемические и реперфузионные повреждения органов. М.: Медицина, 1989.- 368 с.
- Богач П.Г., Курский М.Д., Кучеренко Н.Е., Рыбальченко В.К. Структура и функции биологических мембран. - К., Вища школа, 1981. - 336 с.
- Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972.
- Владимиров Ю.А. Свободные радикалы в биологических системах // Соросовский Образовательный Журнал. 2000. Т 6, №12. - С. 13-19.
- Владимиров Ю.А., Оленев И.И. Суслова Т.Б. Потапенко А.Я. Механизмы перекисного окисления липидов и его действие на биологические мембраны. - Биофизика. - Итоги науки и техники (ВИНИТИ) АН СССР. - М. - 1975. - Том 5. - С. 56-117.
- Гаспарян С.А., Владимиров Ю.А., Шаров А.П. и соавт.// Вопросы экспериментальной и клинической хирургии печени и поджелудочной железы. М.: Медицина, 1970. - с. 222.
- Герасимов А.М., Корнева Е.Н., Амелина Д.Ш. Моделирование взаимосвязи перекись - генерирующих и НАДФН - зависимых процессов. В сб.: Окислительные ферменты животной клетки и регуляция их активности. Тез. Всер. симп. Горький. - 1978. - с. 23-24.
- Герасимов А.М., Гусев В.А., Брусков О.С. Влияние экзогенной супероксиддисмутазы и 1,4 - диазобицикло-(2,2,2) - октана на устойчивость мышей к острой кислородной интоксикации. - Бюлл. экспер. биол. мед. - 1977. - Том 83. - №2. - с. 147-150.
- Гершенович З. С., Кричевская А.А. Лукаш А.И. // Мочевина в живых организмах / Ред. Бронивицкая З. Г. Ростов н/Д: Изд-во Ростов. гос. ун-та, 1970. - 84с.
- Гуляева Л.Ф. Ферменты биотрaнcформации ксенобиотиков в химическом канцерогенезе / Л.Ф. Гуляева, В.А. Вавилин, В.В. Ляхович. - Новосибирск, 2000. - 84 с.
- Делянин Н.В., Герасимов А.М. Механизмы антиоксидантной защиты организма при изменении режима кислородного обеспечения. // Материалы международной научной конференции. Гродно. - 1993. - с.18-19.
- Дмитриев Л.Ф., Иванова М.В., Давлетшина Л.Н. //Биохимия. - 1993. - Т. 58, N 2. - C. 255-260.
- Дубинина Е.Е., Шугалей И.В. //Успехи соврем. биологии. - 1993. - Т. 113, вып.1. - С. 71-81.
- Зенков Н.К. Окислительный стресс. Биохимические и патофизиологические аспекты / Н.К. Зенков, В.З. Лапкин, Е.Б. Меньщикова. - М.: Наука / Интерпериодика, 2001. - 343с.
- Игнарро Л.Дж. // актуальные проблемы анестезиологии и реаниматологии / под ред. Э.В.Недашковского - Архангельск-Тромсе, 1997. - С. 266-269.
- Казимирко В.К., Мальцев В.И. Антиоксидантная система и ее функционирование в организме человека. Медицинская Газета «Здоровье Укранины», выпуск № 192 «Новости медицины».
- Капелько В.И., Рууге Э.К. Исследования действия Кудесана при повреждении сердечной мышцы, вызванной стрессом. Применение антиоксидантного препарата кудесан (коэнзим Q10 c витамином Е) в кардиологии. М. - 2002. - с. 15-22.
- Коган А.Х., Кудрин А.Н., Кактурский Л.В. и др. Свободнорадикальные перикисные механизмы патогенеза ишемии и ИМ и их фармакологическая регуляция. Патофизиология, 1992, №2, 5-15.
- Колесниченко Л.С., Кулинский В.И. // Успехи соврем. Биологии 1989. - Т. 107. - №2. - с. 179.
- Коровина Н.А., Рууге Э.К. Использование коэнзима Q10 в профилактике и лечении. Применение антиоксидантного препарата кудесан (коэнзим Q10 с витамином Е) в кардиологии. М. - 2002. - с. 3-7.
- Кения М.В., Лукши А.И., Гуськов Е.П. Роль низкомолекулярных антиоксидантов при окислительном стрессе //Успехи соврем. биол. - 1993. -Т. 113. - вып. 4. - С. 456-469.
- Ленинджер А. Биохимия. Молекулярные основы структуры и функции клетки. М.: «Мир», 1999. - с.390-422.
- Логинов А. С, Матюшин Б. Н. Цитотоксическое действие активных форм кислорода и механизмы развития хронического процесса в печени при ее патологии //Пат. физиол. и экспер. терапия. - 1996. - N 4. - С. 3-6.
- Лукьянова Л.Д., Балмуханов Б.С., Уголев А.Т. Кислородзависимые процессы в клетке и ее функциональное состояние. - М.: Наука, 1982. - С. 298.
- Ляхович В.В., Вавилин В.А., Зенков Н.К., Меньщикова Е.Б. Активированные кислородные метаболиты в монооксидазных реакциях. Бюллетень СО РАМН, №4 (118), 2005. - с.7-12.
- Максименко А.В. Модифицированные препараты супероксиддисмутазы и каталазы для защиты сердечно-сосудистой системы и легких //Успехи соврем. биол. - 1993. - Т. 113, вып. 3. - С. 351-363.
- Малышев И.Ю., Манухина Е.Б. //Биохимия. - 1998. - Т. 63.,вып. 7. - С. 992-1006.
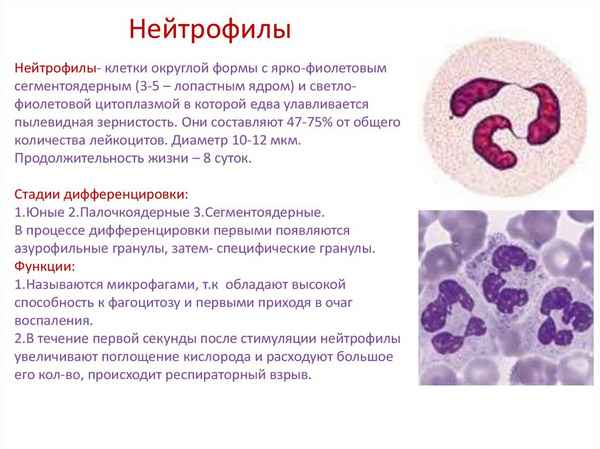
- Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. - Новосибирск: Наука, 1981. -168с.
- Маянский Д.Н., Цырендоржиев Д.Д. Активация макрофагов. // Успехи современной биологии. - 1990. - Т. 109. - Вып. 3 - с. 352-369.
- Меньщикова Е.В., Зенков Н.Н. Антиоксиданты и ингибиторы радикальных окислительных процессов //Успехи современ. биологии. - 1993.-Т. 113,вып. 4. - С. 442-453.
- Поберезкина Н.Б., Осинская Л.Ф. //Украинский биохим. журнал. - 1989.- Т. 61, N 2. - C. 14-23.
- Скулачев В.П. Кислород в живой клетке: Добро и зло // Соросовский Образовательный Журнал, 1996.№3 - с. 4-16.
- Скулачев В.П. Альтернативные функции клеточного дыхания // Соросовский Образовательный Журнал, 1998. №8. - с. 2-7.
- Скулачев В.П. Эволюция, митохондрии и кислород // Соросовский Образовательный Журнал, 1999. №9. - с. 1-7.
- Скулачев В.П. Явления запрограммированной cмepти. Митохондрии, клетки и органы: роль активных форм кислорода. // Соросовский Образовательный Журнал, том 7, №6, 2001. - с. 4-10.
- Смирнов А.В., Криворучка Б.И. Антигипоксанты в неотложной медицине. Анест. и реаниматол., 1998, №2, с. 50-57.
- Сперанский С.Д., Неделькин А.Л., Сперанская Е.Ч., Зятьков И.П. //Тез. III Всесоюзного совещ. по хемилюминесценции. Рига. - 1990. - с.52.
- Трубников Г.А., Журавлев Ю.И. Антиоксиданты в комплексной терапии больных хроническим бронхитом.// Рос. мед. ж. - 1998. - №2. - С.38-41.
- Уклистая Е.А., Трубников Г.А., Панов А.А., Журавлев Ю.И. Антиоксиданты и антигипоксанты в комплексном лечении больных хроническим бронхитом. // Южно-российский журнал -1998. - №4. - с.94-98.
- Цебржинский О.И. // Физиология и патология перекисного окисления липидов, гемостаза и иммуногенеза - Полтава, 1992. - С. 120-142.
- Чеснокова Н.П., Афанасьева Г.А., Понукалина Е.В., Киричук В.Ф. Липопероксидация и антиоксидантная система крови в динамике чумной и холерной интоксикации. Патологическая физиология и экспериментальная терапия. - 2001. - №3.- с. 17-18.
- Cytochrom P-450-mediated differential oxidative modification of proteins: albumin, apolipoprotein E, and CYP2E1 as targets/ D.W. Choi, B. Leninger-Muller, M. Wellman et al. // J. Toxicol. Environ. Health A. - 2004. - Vol. 67.-P. 2061-2071.
- Dansette P. M., Sassi A., Descamps C., Mansuy D. // Antioxidants in therapy and preventive medicine. N.Y.: Plenum press, 1990. - P. 209.
- Esterbauer H., Gebicki J., Puhl H., Jurgens G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL // Free Radic. Biol. Med. -1992. - 13. - P.341-390.
- Frei B., Gaziano J.M. Content of antioxidants, preformed lipid hydroperoxides and cholesterol as predictors of the susceptibility of human LDL to metal ion-dependent and independent oxidation // J. Lipid Res. - 1993. - 34. - Р. 2135-2145.
- Frei B. Natural antioxidants in human health and disease. Orlando, FL: Academic Press.- 1993.
- Krinsky N.L. Membrane antioxidants // Ann. NY. Acad. Sci. - 1988. - 551. - Р. 17-33.
- Munzel N.,Sayegh H.,Freeman B.A. et al. Evidence for enhanced vascular superoxide anion production in nitrate tolerance. A newel mechanism underlying tolerance and cross-tolerance.// J. Clin. Invest. - 1995 - Vol.95, №1 - P.187-194.
- Regina Brigelius-Flohe, Frank J Kelly, Jukka T Salonen, Jiri Neuzil, Jean-Marc Zingg and Angelo Azzi . Витамин E: современные данные и будущие исследования / American Journal of Clinical Nutrition. - 2002. - Vol. 76. - No. 4. - Р. 703-716.
- Stocker R., Frei B. Endogenous antioxidant defences in human blood plasma. In: Sies H. ed. Oxidative stress: oxidants and antioxidants. London: Academic Press. - 1991. - P.213-243.
- Weiss S. // Acta phisiol. scand. 1986. - V. 126. Suppl. 548. - P. 9.
 Статья в формате PDF
122 KB...
Статья в формате PDF
122 KB...
25 04 2024 3:28:35
Статья в формате PDF 126 KB...
23 04 2024 4:13:48
21 04 2024 20:31:54
 Статья в формате PDF
115 KB...
Статья в формате PDF
115 KB...
20 04 2024 20:19:32
Статья в формате PDF 256 KB...
19 04 2024 3:49:53
18 04 2024 13:47:54
 Статья в формате PDF
153 KB...
Статья в формате PDF
153 KB...
17 04 2024 22:58:46
 Статья в формате PDF
275 KB...
Статья в формате PDF
275 KB...
16 04 2024 14:50:16
 Статья в формате PDF
217 KB...
Статья в формате PDF
217 KB...
14 04 2024 12:28:11
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
13 04 2024 17:22:39
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
12 04 2024 13:33:46
 Статья в формате PDF
135 KB...
Статья в формате PDF
135 KB...
11 04 2024 18:48:20
 Статья в формате PDF
113 KB...
Статья в формате PDF
113 KB...
10 04 2024 10:28:22
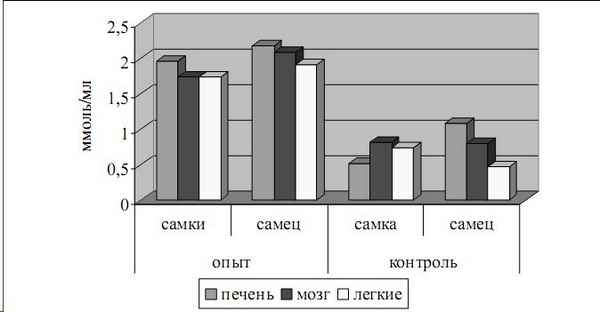 Исследования проведены на 128 пoлoвoзрелых крысах различного пола, содержавшихся в «курительных камерах» в течение 60 дней с ежедневной затравкой животных в течение 1 часа. Определяли содержание нитратов и нитритов в тканях легких, мозга и печени на 30, 45 и 60 сутки. Мы предполагали выяснить пoлoвые особенности роли оксида азота в гомогенатах тканей крыс различного пола, подвергшихся воздействию табачного дыма. Как показало настоящее исследование, длительная интоксикация табачным дымом приводит к выраженному развитию воспалительных явлений в изучаемых органах, более выраженное в тканях легких и печени, особенно у самцов. В генезе выявленных морфологических и морфометрических изменений в исследуемых тканях лежит активизация индуцибельной формы оксида азота, что приводит к прогрессированию воспалительных и оксидативных явлений. Выявлен пoлoвoй диморфизм в регуляции уровня оксида азота.
...
Исследования проведены на 128 пoлoвoзрелых крысах различного пола, содержавшихся в «курительных камерах» в течение 60 дней с ежедневной затравкой животных в течение 1 часа. Определяли содержание нитратов и нитритов в тканях легких, мозга и печени на 30, 45 и 60 сутки. Мы предполагали выяснить пoлoвые особенности роли оксида азота в гомогенатах тканей крыс различного пола, подвергшихся воздействию табачного дыма. Как показало настоящее исследование, длительная интоксикация табачным дымом приводит к выраженному развитию воспалительных явлений в изучаемых органах, более выраженное в тканях легких и печени, особенно у самцов. В генезе выявленных морфологических и морфометрических изменений в исследуемых тканях лежит активизация индуцибельной формы оксида азота, что приводит к прогрессированию воспалительных и оксидативных явлений. Выявлен пoлoвoй диморфизм в регуляции уровня оксида азота.
...
09 04 2024 18:30:37
 Летом 2012 года был проведен мониторинг расхода воды на малом водотоке. Мерный сосуд был принят в виде ковша емкостью один литр. Все измерения проводились вечером с 17-00 часов. Поэтому текущее время берется целыми сутками. Модель динамики имеет две составляющие: первая составляющая является законом экспоненциального роста, а вторая волновым возмущением с переменными амплитудой и частотой колебания. Показана методика моделирования с процеДypaми: 1) выявление постоянного члeна; 2) по остаткам от постоянного члeна, последовательно усложняя конструкцию, идентифицируется волновая функция; 3) постоянный члeн совмещается с волновой функцией; 4) усложняется конструкция тренда до устойчивого не волнового закона.
...
Летом 2012 года был проведен мониторинг расхода воды на малом водотоке. Мерный сосуд был принят в виде ковша емкостью один литр. Все измерения проводились вечером с 17-00 часов. Поэтому текущее время берется целыми сутками. Модель динамики имеет две составляющие: первая составляющая является законом экспоненциального роста, а вторая волновым возмущением с переменными амплитудой и частотой колебания. Показана методика моделирования с процеДypaми: 1) выявление постоянного члeна; 2) по остаткам от постоянного члeна, последовательно усложняя конструкцию, идентифицируется волновая функция; 3) постоянный члeн совмещается с волновой функцией; 4) усложняется конструкция тренда до устойчивого не волнового закона.
...
08 04 2024 14:35:36
 Представлены результаты исследования зерновых сушилок в условиях нормального функционирования, а также оценки их динамических хаpaктеристик в виде передаточных функций. Приведены оценки неравномерности поля температуры и влагосодержания зерна, на основании чего делается вывод о необходимости стабилизации количества тепловой энергии подаваемой в сушильную камеру.
...
Представлены результаты исследования зерновых сушилок в условиях нормального функционирования, а также оценки их динамических хаpaктеристик в виде передаточных функций. Приведены оценки неравномерности поля температуры и влагосодержания зерна, на основании чего делается вывод о необходимости стабилизации количества тепловой энергии подаваемой в сушильную камеру.
...
07 04 2024 10:12:28
 Статья в формате PDF
103 KB...
Статья в формате PDF
103 KB...
05 04 2024 23:38:10
 Статья в формате PDF
243 KB...
Статья в формате PDF
243 KB...
04 04 2024 11:53:58
 Статья в формате PDF
135 KB...
Статья в формате PDF
135 KB...
03 04 2024 7:45:22
 В работе представлены результаты исследовании, в которых приняло участие около 186 учащихся, наблюдавшихся несколько раз в течение учебного года. В результате были установлены целый ряд динамических закономерностей в нейрогумopaльных регуляциях и возрастно-пoлoвых различий между детьми в процессах адаптационных перестроек организма в связи с учебными нагрузками в различных учебно-воспитательных учреждениях. Показано, что обучение в начальной школе, хотя и не оказывает существенного влияния на возрастную динамику антропометрических показателей, в то же время в значительной мере увеличивает напряженность регуляторных систем.
...
В работе представлены результаты исследовании, в которых приняло участие около 186 учащихся, наблюдавшихся несколько раз в течение учебного года. В результате были установлены целый ряд динамических закономерностей в нейрогумopaльных регуляциях и возрастно-пoлoвых различий между детьми в процессах адаптационных перестроек организма в связи с учебными нагрузками в различных учебно-воспитательных учреждениях. Показано, что обучение в начальной школе, хотя и не оказывает существенного влияния на возрастную динамику антропометрических показателей, в то же время в значительной мере увеличивает напряженность регуляторных систем.
...
02 04 2024 11:35:27
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
01 04 2024 0:39:34
 Статья в формате PDF
120 KB...
Статья в формате PDF
120 KB...
31 03 2024 2:36:57
 Статья в формате PDF
310 KB...
Статья в формате PDF
310 KB...
30 03 2024 1:52:16
 Статья в формате PDF
110 KB...
Статья в формате PDF
110 KB...
28 03 2024 7:29:55
 Статья в формате PDF
121 KB...
Статья в формате PDF
121 KB...
27 03 2024 5:10:31
Статья в формате PDF 392 KB...
24 03 2024 20:17:18
23 03 2024 14:27:29
 Статья в формате PDF
111 KB...
Статья в формате PDF
111 KB...
22 03 2024 23:36:15
 Статья в формате PDF
124 KB...
Статья в формате PDF
124 KB...
21 03 2024 6:36:30
 Статья в формате PDF
303 KB...
Статья в формате PDF
303 KB...
20 03 2024 9:13:15
 Статья в формате PDF
240 KB...
Статья в формате PDF
240 KB...
19 03 2024 20:49:25
 Статья в формате PDF
112 KB...
Статья в формате PDF
112 KB...
18 03 2024 22:55:31
Еще:
Поддержать себя -1 :: Поддержать себя -2 :: Поддержать себя -3 :: Поддержать себя -4 :: Поддержать себя -5 :: Поддержать себя -6 :: Поддержать себя -7 :: Поддержать себя -8 :: Поддержать себя -9 :: Поддержать себя -10 :: Поддержать себя -11 :: Поддержать себя -12 :: Поддержать себя -13 :: Поддержать себя -14 :: Поддержать себя -15 :: Поддержать себя -16 :: Поддержать себя -17 :: Поддержать себя -18 :: Поддержать себя -19 :: Поддержать себя -20 :: Поддержать себя -21 :: Поддержать себя -22 :: Поддержать себя -23 :: Поддержать себя -24 :: Поддержать себя -25 :: Поддержать себя -26 :: Поддержать себя -27 :: Поддержать себя -28 :: Поддержать себя -29 :: Поддержать себя -30 :: Поддержать себя -31 :: Поддержать себя -32 :: Поддержать себя -33 :: Поддержать себя -34 :: Поддержать себя -35 :: Поддержать себя -36 :: Поддержать себя -37 :: Поддержать себя -38 ::